 p Imagem:Harder Group
p Imagem:Harder Group
p Químicos da Friedrich-Alexander-University Erlangen-Nürnberg publicaram um avanço na química do magnésio no jornal
Natureza . p O magnésio (Mg) é um metal do grupo principal inicial abundante em terra e de baixa eletronegatividade que facilmente perde seus elétrons de valência. Em combinação com outros elementos, ocorre naturalmente apenas em sua forma mais estável como o Mg carregado positivamente
2+
cátion. O Mg
2+
cátion é encontrado em vários minerais, mas também na clorofila, o pigmento que torna as plantas verdes. O magnésio no estado de oxidação anormal + I foi detectado pela primeira vez em nuvens interestelares, mas recentemente, primeiros complexos com Mg
+
foram isolados.
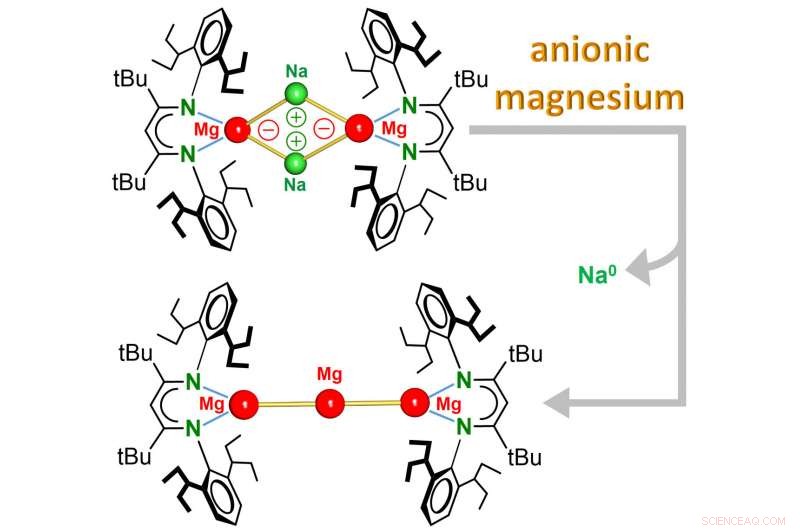
p A equipe em torno do Prof. Sjoerd Harder (Presidente de Química Inorgânica e Organometálica) agora relata a descoberta do primeiro Mg
0
complexos em que o metal tem um estado de oxidação igual a zero e mesmo com carga negativa. Esses complexos, que contêm ligação única de magnésio-sódio (Mg-Na), reagem de maneira completamente diferente do Mg comum
2+
compostos. Enquanto Mg pobre em elétrons
2+
cátions podem aceitar elétrons, o Mg aniônico rico em elétrons
0
centro reage doando elétrons.
p O complexo é solúvel em solventes orgânicos comuns e é um agente redutor extremamente forte:ligeiro aquecimento levou à redução imediata do Na
+
cátions para Na
0
, um metal que normalmente tem uma forte tendência a oxidar em Na
+
cátions. Durante esta decomposição térmica, um novo tipo de complexo é formado no qual três átomos de Mg se conectam como contas em uma cadeia. Este Mg
3
aglomerado reage como Mg atômico
0
e pode ser visto como o menor pedaço de metal Mg, que é solúvel em solventes orgânicos. Esta nova classe de complexos aniônicos de Mg vira a química do Mg completamente de cabeça para baixo. Mais reatividade incomum deste solúvel, extremamente forte, agente redutor pode ser esperado.
