Em 1869, Dmitri Mendeleev publicou um artigo intitulado "Sobre a relação das propriedades dos elementos com seus pesos atômicos". Nesse artigo, ele produziu um arranjo ordenado dos elementos, listando-os em ordem crescente de peso e organizando-os em grupos com base em propriedades químicas semelhantes. Embora muitas décadas restassem antes que os detalhes da estrutura atômica fossem descobertos, a tabela de Mendeleev já organizava elementos em termos de sua valência.
Elementos e peso atômico
No tempo de Mendeleev, pensava-se que os átomos eram indivisíveis, entidades únicas . Alguns eram mais pesados que outros, e parecia razoável encomendar os elementos aumentando o peso. Há dois problemas com esta abordagem. Primeiro, medir o peso é uma tarefa complicada, e muitos dos pesos aceitos na época de Mendeleev não estavam corretos. Segundo, verifica-se que o peso atômico não é realmente o parâmetro relevante. As tabelas periódicas de hoje colocam os elementos em ordem de seu número atômico, que é o número de prótons no núcleo. No tempo de Mendeleev, os prótons ainda não haviam sido descobertos.
Elementos e propriedades químicas
Mendeleev escreveu que "o arranjo de acordo com o peso atômico corresponde à valência do elemento e, em certa medida, à diferença no comportamento químico. . " A valência, no entendimento de Mendeleev, era uma indicação da capacidade de um elemento se combinar com outros elementos. Mendeleev combinou a ordem do peso atômico com valências comuns para organizar os elementos em uma tabela. Ou seja, ele organizou os elementos em grupos de acordo com suas características químicas. Como essas propriedades se repetem de vez em quando, o resultado foi uma tabela periódica na qual cada coluna vertical, chamada grupo, contém elementos com características semelhantes, e cada linha horizontal, chamada período, organiza os elementos em peso, aumentando da esquerda para a direita e de cima para baixo. Estrutura atômica
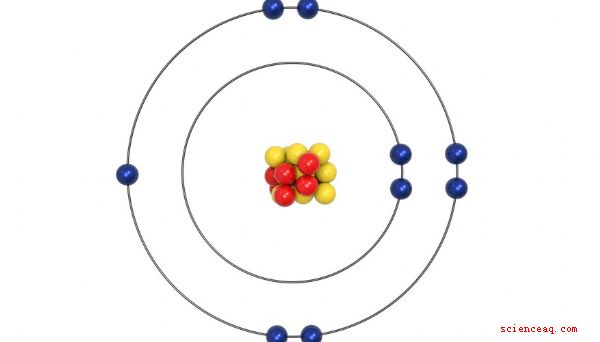
Cerca de 50 anos após a primeira tabela periódica de Mendeleev, os cientistas descobriram que o átomo era construído em torno de um núcleo com prótons com carga positiva e nêutrons neutros - ambos relativamente pesados. O núcleo carregado positivamente é cercado por uma nuvem de elétrons carregados negativamente. O número de prótons - também chamado número atômico - normalmente corresponde ao número de elétrons. Acontece que o número de elétrons de um elemento determina em grande parte suas propriedades químicas. Portanto, a ordem correta na tabela periódica é determinada pelo número de elétrons, e não pelo peso, como Mendeleev propôs originalmente.
Valence Electrons
Os elétrons na nuvem que rodeia o núcleo de um elemento são organizados em camadas, chamadas de conchas . Cada invólucro possui um número específico de elétrons que pode conter. Quando cada camada é preenchida, uma nova camada é adicionada até que todos os elétrons sejam contabilizados. Os elétrons na camada mais externa são chamados elétrons de valência, porque são suas interações que determinam as propriedades químicas de um elemento. As colunas que foram configuradas para agrupar elementos por propriedades químicas semelhantes acabam sendo exatamente as mesmas colunas definidas pelo número de elétrons de valência. Os elementos do grupo 1A têm apenas um elétron de valência e cada coluna do grupo A à direita adiciona mais um elétron de valência. A organização fica um pouco obscura com os elementos do Grupo B, mas cada um deles também é agrupado pelo número de elétrons de valência.