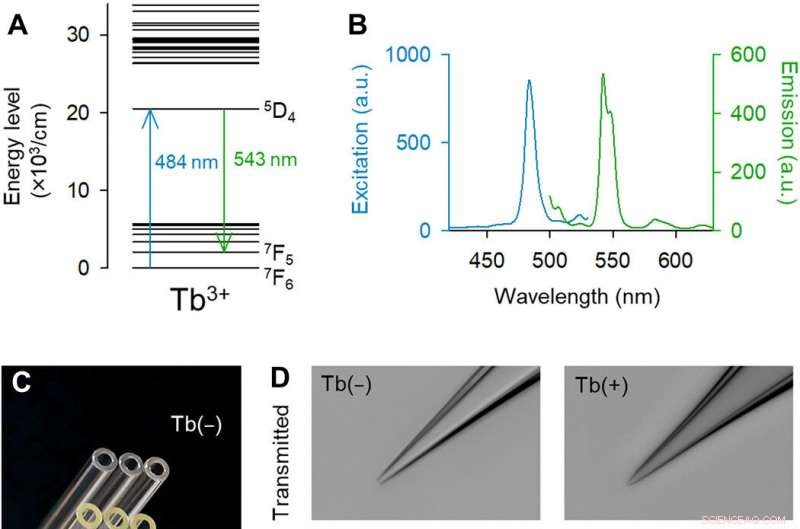
Pipetas dopadas com Tb3 + emitem fluorescência verde. (A) Diagrama de nível de energia parcial de Tb3 + [extraído parcialmente de (14)]. (B) Espectros de excitação (azul) e emissão (verde) de 3,1 mol% de vidro dopado com Tb3 +. (C) Fotografia macroscópica colorida dos capilares de vidro controle (superior) e dopados com Tb3 + (inferior). Crédito da foto:Yuji Ikegaya, A Universidade de Tóquio. (D) Imagens monocromáticas de campo claro (parte superior) e fluorescência (parte inferior) das pontas das pipetas de vidro dopadas com Tb3 + (direita) (excitação a laser 488 nm a 25 mW). Pipetas feitas de vidro dopado com Tb3 + emitiram fluorescência verde. Crédito da foto:Kazuki Okamoto, A Universidade de Tóquio e a Universidade Juntendo. (E) Imagem de microscopia eletrônica de varredura da ponta de uma pipeta dopada com Tb3 +. Crédito da foto:Hiroyuki Hioki, Juntendo University. (F) Resistências das pipetas de controle (preto) e pipetas dopadas com Tb3 + (verde). Os retângulos mostram as medianas e os percentis 25 e 75, e os bigodes exibem os percentis 10 e 90. n =48 pipetas, Teste t de Student. (G) O mesmo que (F), mas para capacitâncias de pipeta. n =7 a 8 pipetas, Teste t de Student. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529
As investigações e manipulações ópticas freqüentemente formam o núcleo dos experimentos biológicos. Em um novo relatório agora publicado em Avanços da Ciência , Kazuki Okamato e uma equipe de cientistas em ciências farmacêuticas, neurociência, Medicina, física e inteligência artificial na Universidade de Tóquio, Japão, introduziu um novo material de vidro de borosilicato contendo um térbio de íon de terras raras (III) (Tb 3+ ) O material emitiu fluorescência verde após excitação de luz azul, muito parecido com a proteína fluorescente verde (GFP) com ampla compatibilidade em ambientes de pesquisa biológica. Usando micropipetas feitas de vidro dopado com térbio, Okamato et al. células marcadas com GFP direcionadas para eletroporação de célula única, análise de transcriptoma de célula única e experimentos de gravação patch-clamp sob controle microscópico de fluorescência em tempo real. O vidro também mostrou potencial de geração de terceiro harmônico mediante excitação de laser infravermelho, útil para direcionamento óptico online de neurônios marcados com fluorescência no neocórtex in vivo. Desta maneira, o vidro dopado com térbio simplificou procedimentos múltiplos em experimentos biológicos com aplicações mais amplas na pesquisa biomédica.
Conduzindo investigações ópticas in vivo
Investigações ópticas e manipulações de células em tecidos vivos são amplamente difundidas na pesquisa biológica, com capacidade de revelar diversas propriedades nas células e durante a comunicação intracelular. Embora a marcação genética tenha permitido a identificação de células que expressam proteínas fluorescentes, continua difícil acessar células marcadas com fluorescência usando pipetas de vidro, uma vez que o vidro não é fluorescente na faixa visível. Para resolver esses problemas técnicos, Okamato et al. introduziu uma nova composição de vidro de borosilicato. Os íons de terras raras exibiram emissão de fluorescência única com picos agudos no espectro de luz visível. A equipe se concentrou em térbio (III) (Tb 3+ ), que têm estruturas de nível de energia complexas e teoricamente espera-se que emitam fluorescência verde. O comprimento de onda de excitação estava próximo da visibilidade mais alta para os olhos humanos e próximo ao da proteína fluorescente verde. Como resultado, pipetas feitas de vidros dopados com térbio foram úteis para direcionamento de fluorescência, manipulação de uma única célula nas ciências da vida.
Eletroporação de célula única com alvo fluorescente e análise de transcriptoma usando pipetas dopadas com Tb3 +. (A) Eletroporação de gene de célula única usando pipetas dopadas com Tb3 +. Uma pipeta dopada com Tb3 + contendo um vetor pCMV-tdTomato foi anexada a uma célula piramidal do hipocampo EGFP-positiva em uma cultura organotípica (topo; DiV 16), e pulsos elétricos foram aplicados. Após 48 horas, o neurônio-alvo expressou tdTomato (parte inferior). Barra de escala, 20 μm. (B) Patch-seq usando pipetas dopadas com Tb3 +. Uma pipeta dopada com Tb3 + foi anexada a um interneurônio GABAérgico positivo para GFP em uma fatia aguda cortical de um camundongo transgênico PV-GFP, e o RNA foi extraído aplicando sucção (topo). Barra de escala, 50 μm. Transcrições por milhão (TPM) de células GFP-positivas e GFP-negativas (parte inferior). Pontos cinza indicam todos os transcritos de genes detectados. Os pontos vermelhos são transcritos de genes únicos representativos, Pvalb e Gad2 (GAD65) para células GFP-positivas versus Mef2c e Slc17a7 (VGLUT1) para células não-GFP-positivas. Crédito da foto:Kazuki Okamoto, A Universidade de Tóquio e a Universidade Juntendo. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529 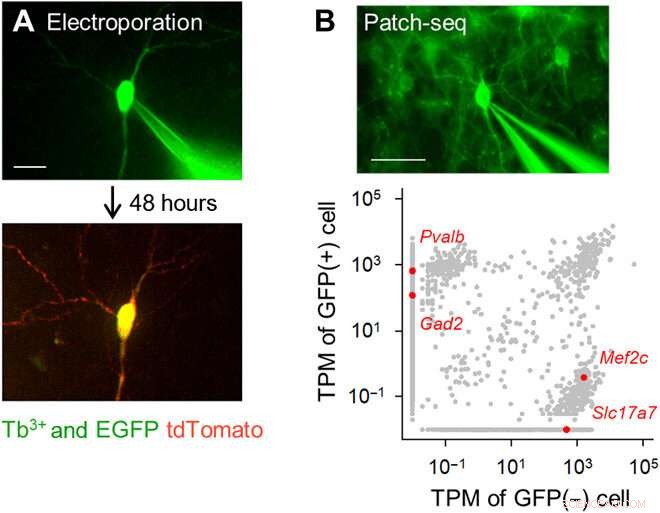
A equipe desenvolveu o vidro de borosilicato usando 3,1 por cento molar (mol%) de óxido de térbio (Tb 2 O 3 ) O térbio (Tb 3+ ) - o vidro dopado emitiu fluorescência verde visível a olho nu, mesmo sob a luz do quarto. The Tb 3+ -vidro dopado teve um pico de absorção em um comprimento de onda de 484 nm, o que não foi observado em vidro de borosilicato normal sem térbio. Os cientistas produziram capilares de vidro e pipetas onde o vidro moldado continuou a emitir fluorescência verde. Usando microscopia eletrônica de varredura, a equipe verificou as pontas da pipeta em busca de quaisquer aberrações que pudessem afetar a qualidade dos registros eletrofisiológicos. Okamato et al. em seguida, usou as novas micropipetas para conduzir a eletroporação de uma única célula de uma proteína fluorescente vermelha (tdTomato) em neurônios em estruturas de fatias hipocampais organotípicas de ratos. Eles viram as pipetas contendo o vetor de corante vermelho e células piramidais que foram minimamente marcadas com GFP aprimorado, usando o mesmo aparelho óptico. Os cientistas colocaram as pontas das pipetas nas células e aplicaram pulsos elétricos para eletroporação para facilitar a expressão do corante vermelho após 48 horas. Depois disso, a equipe realizou o sequenciamento de RNA de uma única célula com as pipetas em fatias agudas do córtex motor primário de camundongos transgênicos.
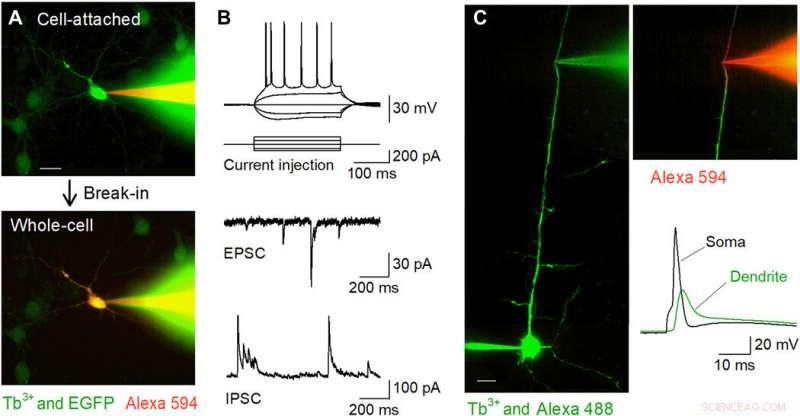
Gravações de patch-clamp com alvo fluorescente in vitro usando pipetas dopadas com Tb3 +. (A) Imagens confocais do disco de Nipkow durante a gravação de patch-clamp de um neurônio do hipocampo cultivado com EGFP-positivo (verde) usando uma pipeta dopada com Tb3 + (verde) preenchida com Alexa Fluor 594 (vermelho). A célula foi capturada no modo de célula anexada (parte superior) e, em seguida, mantida no modo célula inteira (parte inferior). Barra de escala, 20 μm. (B) Formas de onda representativas de potenciais de ação induzidos pela injeção de corrente (topo), EPSCs espontâneos (meio), e IPSCs espontâneos (parte inferior) registrados a partir de células piramidais CA1 em fatias agudas do hipocampo usando pipetas dopadas com Tb3 +. (C) Gravações de patch-clamp dendríticas direcionadas usando pipetas dopadas com Tb3 +. Uma célula piramidal de camada 5 foi carregada intracelularmente com Alexa Fluor 488 por meio de gravação somática de células inteiras, e seu dendrito apical foi direcionado para posterior gravação de células inteiras usando uma pipeta dopada com Tb3 + sob visualização confocal em disco de Nipkow. Barra de escala, 20 μm. Após o arrombamento, o dendrito foi visualizado por Alexa Fluor 594 carregado intracelularmente por meio da pipeta dopada com Tb3 + (parte superior direita). Um potencial de ação retropropagante foi registrado pela pipeta dopada com Tb3 + após um potencial de ação evocado no soma (parte inferior direita). Crédito da foto:Kazuki Okamoto, A Universidade de Tóquio e a Universidade Juntendo. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529
Usando as novas micropipetas para gravações de patch clamp in vitro
Em seguida, os pesquisadores realizaram gravações de patch-clamp de culturas primárias de neurônios do hipocampo que foram esparsamente marcados com GFP usando uma pipeta dopada com térbio carregada com um corante fluorescente vermelho (Alexa Fluor 594). As pipetas preencheram com sucesso as células-alvo com o corante e as mantiveram na configuração de célula inteira. A equipe aplicou o mesmo método para preparações de fatias cerebrais agudas, onde os neurônios estavam localizados mais profundamente em tecidos menos transparentes do que os neurônios em cultura. Quando Okamato et al. células piramidais corrigidas nas fatias agudas do hipocampo usando pipetas dopadas com térbio, os neurônios mostraram potenciais de ação normais em resposta a breves injeções atuais. As células exibiram correntes pós-sinápticas excitatórias e inibitórias espontâneas normais sob a configuração de pinça de voltagem. As micropipetas podiam ser usadas para gravações estáveis de longo prazo e também eram úteis para gravações de neurites. A equipe registrou os potenciais de ação backpropagating usando a configuração de dendritos direcionados.
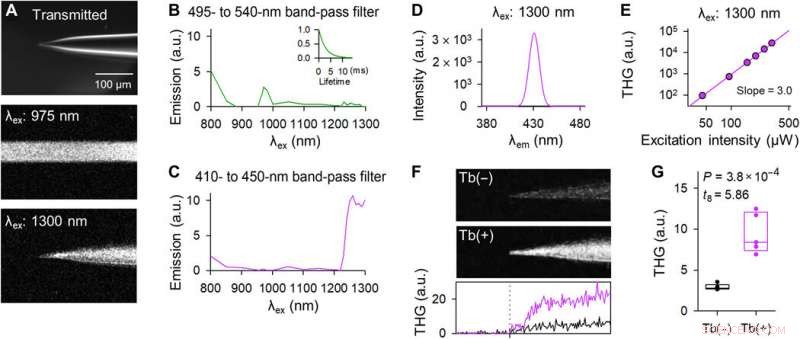
Pipetas dopadas com Tb3 + emitem THG após excitação de laser de 1300 nm. (A) Imagens representativas da ponta de uma pipeta dopada com Tb3 + no campo claro (topo), fluorescência de dois fótons sobre excitação de laser de 975 nm (meio), e emissão harmônica de três fótons sobre excitação de laser de 1300 nm (parte inferior). As imagens do meio e da parte inferior foram adquiridas com uma varredura horizontal de 2 μs por pixel e empilhadas em z. (B) O espectro de excitação através de um filtro de passagem de banda de 495 a 540 nm. O gráfico inserido indica a curva de decaimento de fluorescência após excitação de 975 nm. (C) O mesmo que (B), mas por meio de um filtro passa-banda de 410 a 450 nm. (D) O espectro de emissão após excitação de 1300 nm foi medido usando um monocromador. (E) Gráfico logarítmico duplo da intensidade THG em função da potência do laser de 1300 nm. A linha de regressão teve uma inclinação de 3,0. (F) Imagens THG das pontas das pipetas de controle (topo) e pipetas dopadas com Tb3 + (meio). As imagens foram empilhadas em z. O gráfico inferior representa a intensidade de THG de controle (preto) e pipetas dopadas com Tb3 + (roxo). A linha pontilhada vertical indica a localização da ponta. (G) As intensidades de THG das pipetas dopadas com Tb3 + (roxas) foram mais fortes do que as das pipetas de controle (pretas). Os retângulos mostram as medianas e os percentis 25 e 75. n =5 pipetas, Teste t de Student. Crédito da foto:Teppei Ebina, A Universidade de Tóquio. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529
Gravações de patch-clamp in vivo usando pipetas dopadas com térbio
Okamato et al. next characterized the nonlinear multiphoton excitation of terbium-doped glass using infrared light at wavelengths that were approximately double the single-photon excitation peak (484 nm) of terbium. Using a photomultiplier tube through a 495-to-540 nm band-pass filter, the team captured the green fluorescence emitted by terbium-doped pipettes. The emissions peaked at an excitation wavelength of 975 nm, suggesting that a laser wavelength corresponding to the value excited the glass through a two-photon absorption process. The scientists also noted another bright signal at 1300 nm excitation through a 410-to-450 band pass filter and suggested the signal to have likely arisen from third harmonic generation (THG). Based on the strong THG signal of the micropipettes, Okamato et al. conducted in vivo whole cell patch-clamp recordings with a multiphoton laser microscope. They simultaneously used the cells and terbium-doped pipette using dual-laser irradiation at 1, 040 nm and 1, 300 nm, respectivamente, and recorded the injection-induced action potentials and spontaneous membrane fluctuations under the current-clamp configuration.
THG-based in vivo patch-clamp recordings using Tb3+-doped pipettes. (A) Multiphoton image of an in vivo patch-clamp recording guided by THG of Tb3+-doped pipettes, targeting a cell labeled with tdTomato, which underwent two-photon excitation by a 1040-nm laser (red). The THG of the Tb3+-doped pipette was obtained using a 1300-nm laser (green). (B) Action potentials evoked by a step current injection (bottom) into a layer 2/3 pyramidal cell in the primary motor cortex (top) of an anesthetized mouse were recorded using a Tb3+-doped pipette. (C) Spontaneous membrane potentials were recorded using a Tb3+-doped pipette. Photo credit:Teppei Ebina, A Universidade de Tóquio. Crédito:Science Advances, doi:10.1126/sciadv.abd2529 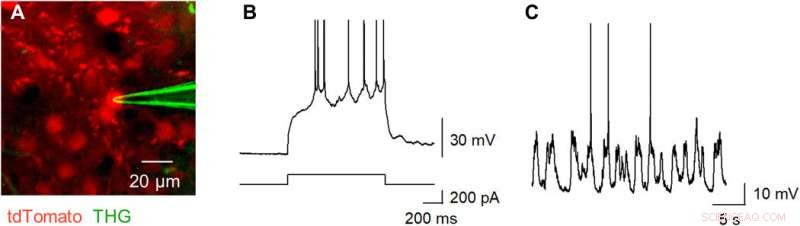
Desta maneira, Kazuki Okamato and colleagues invented a terbium-doped glass emitting green fluorescence signal strong enough to be visible to the naked eye. The material had similar characteristics to conventional borosilicate glass and did not display photobleaching or cytotoxicity. The new micropipettes allowed fluorescence manipulations such as optical targeting of single-cell electroporation, single-cell RNA sequencing and electrophysiological recordings. The glass also emitted third harmonic generation upon three-photon excitation, applicable for in vivo manipulation. The terbium-doped glass therefore provided a platform for multiple purposes in biomedical research including hitherto conventional patch-clamp recordings to open new frontiers in life sciences.
© 2021 Science X Network