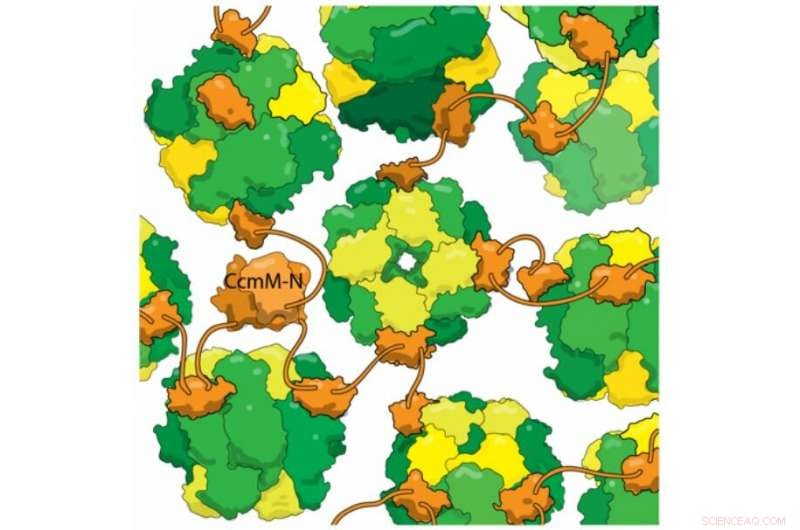
Novas evidências estruturais mostram que a proteína cianobacteriana CcmM (laranja) se liga a enzimas RuBisCo totalmente montadas (amarelo e verde) sem desalojar subunidades RbcS (amarelo). Esta mistura reticulada forma a base do carboxissomo, um compartimento que as bactérias usam para evitar a fotorrespiração. A fotorrespiração é uma etapa perdulária na fotossíntese causada quando RuBisCo fixa oxigênio em vez de dióxido de carbono, e acredita-se que reduza o rendimento de algumas safras em mais de 20%. Ao aprisionar o dióxido de carbono nos carboxissomos, bactérias aumentam sua concentração, ajudando a RuBisCo a corrigir o CO2. Uma visão mais ampla da montagem de carboxissomos pode ajudar a projetar safras de maior rendimento em um futuro próximo.
Esta pesquisa aparece no Journal of Biological Chemistry . Crédito:Ryan et al ., Journal of Biological Chemistry , 2019. (DOI:10.1074 / jbc.RA118.006330)
Os pesquisadores que enfrentam um futuro com uma população maior e um clima mais incerto estão procurando maneiras de melhorar o rendimento das safras, e procuram bactérias fotossintéticas para soluções de engenharia.
No Journal of Biological Chemistry , uma equipe de pesquisa canadense relata como as cianobactérias superam uma das etapas mais inúteis da fotossíntese. O estudo investigou a montagem de carboxissomos em que as bactérias concentram dióxido de carbono, aumentando a eficiência de uma enzima crítica chamada RubisCO.
"Basicamente, tudo o que comemos começa com RubisCO, "disse Matthew Kimber, um professor da Universidade de Guelph em Ontário, Canadá, e autor sênior no artigo recente.
A enzima, que é feito de 16 subunidades de proteína, é essencial para a fotossíntese. Usando a energia capturada da luz, ele incorpora dióxido de carbono em moléculas orgânicas a partir das quais a planta produz um novo açúcar. Infelizmente, não é terrivelmente eficiente. Ou, do ponto de vista de Kimber, "RubisCO tem uma tarefa realmente ingrata."
A enzima evoluiu em um mundo antigo onde o dióxido de carbono era comum e o oxigênio raro. Como resultado, não é muito exigente em discriminar os dois gases. Agora que a situação atmosférica mudou, RubisCO frequentemente captura acidentalmente oxigênio, gerando um composto inútil que a planta então tem que investir energia extra para reciclar.
Comparado com as plantas, as cianobactérias cometem muito poucos desses erros. Isso ocorre porque as bactérias coletam seu RubisCO em corpos densos conhecidos como carboxissomos. A bactéria bombeia bicarbonato (simplesmente CO2 hidratado) para a célula; uma vez que entra no carboxissomo, as enzimas convertem o bicarbonato em dióxido de carbono. Como o dióxido de carbono não consegue escapar através da camada protéica que envolve o carboxissomo, ele se acumula em altas concentrações, ajudando RubisCO a evitar erros caros.
O interesse de Kimber nos carboxissomos está principalmente em compreender a lógica de sua organização. "Eles são, na verdade, máquinas incrivelmente complexas, "ele explica." A cianobactéria produz cerca de onze proteínas de aparência normal, e estes de alguma forma se organizam neste megacomplexo auto-regulado que pode exceder o tamanho de uma pequena célula. "
Um dos truques mais impressionantes dos carboxissomos é a automontagem, que o laboratório de Kimber decidiu entender. Eles analisaram uma proteína chamada CcmM, que encurrala as enzimas RubisCO em novos carboxissomos. Eles sabiam que parte do CcmM se parecia muito com uma subunidade do RubisCO - tanto assim, na verdade, que os pesquisadores suspeitam que as cianobactérias antigas originalmente criaram o CcmM duplicando um gene RubisCO. A maioria dos cientistas da área acredita que o CcmM se liga à enzima usurpando o ponto dessa subunidade. Mas quando o laboratório de Kimber deu uma olhada detalhada no CcmM, usando técnicas de biofísica para observar a estrutura e ligação da proteína, os resultados mostraram que a sabedoria recebida estava errada. Verdade, CcmM era semelhante em forma à pequena subunidade RubisCO. Mas os complexos que ele formou ainda incluíam todas as 8 pequenas subunidades, o que significa que em vez de roubar um ponto de uma subunidade RubisCO, CcmM tinha que ser vinculado em outro lugar completamente.
"Isso é muito estranho de uma perspectiva biológica, porque se CcmM surgiu duplicando a pequena subunidade, é quase certo que originalmente vinculado da mesma maneira, "Kimber disse." Em algum momento, deve ter evoluído para preferir um novo local de ligação. "
Os pesquisadores também descobriram que um linker entre domínios de ligação em CcmM é curto o suficiente para que "em vez de envolver RubisCO, ele se amarra (enzimas individuais) como contas em um cordão. Com vários desses ligantes ligando cada RubisCO aleatoriamente, ele conecta tudo em um grande globo; você envolve uma casca em torno dele, e este então se torna o carboxissomo. "
Cientistas de outra universidade relataram no outono passado que tiveram sucesso em fazer plantas de tabaco com um carboxissomo reduzido em seus cloroplastos. Essas plantas não cresceram muito bem, e os autores concluíram que eles haviam retirado muitos componentes do carboxissomo; embora pudesse ser construído no cloroplasto, era um peso para as plantas em vez de uma ajuda. Ter um melhor entendimento de como proteínas como o CcmM contribuem para a construção e função do carboxissomo pode ajudar os bioengenheiros a alavancar a eficiência do carboxissomo na próxima geração de plantas modificadas.