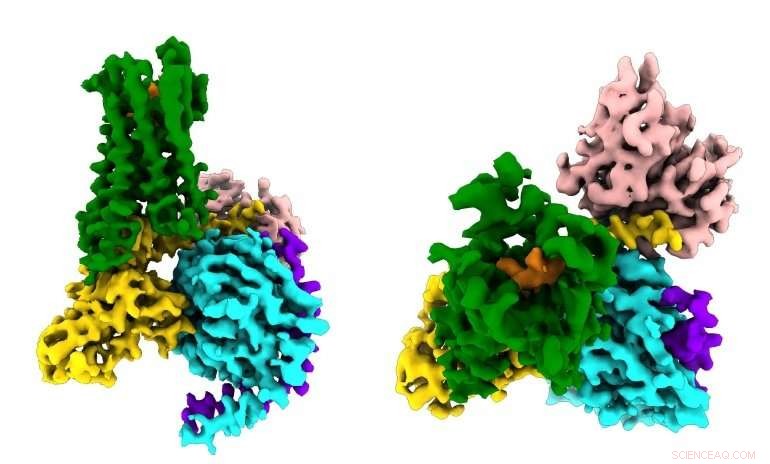
Os pesquisadores veem pela primeira vez como uma droga opioide sintética (laranja) se liga aos receptores opioides µ (verdes) no cérebro, e ativar moléculas de sinalização dentro dos neurônios (G⍺s em ouro, Gβ em ciano, Gγ em roxo) que levam à supressão da dor e ao vício. Crédito:Antoine Koehl (laboratório Manglik)
Drogas opióides como a morfina e o fentanil são a base da medicina moderna para a dor. Mas eles também causam prisão de ventre, são altamente viciantes, e pode levar à insuficiência respiratória fatal se tomado em uma dose muito alta. Os cientistas há muito procuram desenvolver novos medicamentos opióides que podem afastar a dor sem esses efeitos colaterais perigosos, mas lacunas em nossa compreensão de como exatamente os opioides exercem seus vários efeitos em um nível biológico mantiveram esse sonho afastado.
Os analgésicos opioides atuam ligando-se a uma proteína receptora presente nas células nervosas, denominada receptor opioide µ, que evoluiu para responder aos analgésicos naturais do corpo (como as endorfinas produzidas por exercícios) diminuindo a dor e criando uma sensação de euforia. Drogas opióides, do ópio à morfina e à heroína, sequestram esse sistema de sinalização ligando-se à mesma molécula receptora. Mas os detalhes de como a ativação desses receptores desencadeia os efeitos positivos e negativos das drogas permaneceram nebulosos.
Agora, em um estudo publicado em 13 de junho, 2018 em Natureza , cientistas da UC San Francisco e da Universidade de Stanford usaram microscopia crioeletrônica de ultra-alta resolução (cryoEM) para capturar o retrato mais detalhado de uma droga opióide que aciona a cascata de sinalização bioquímica que lhe dá poder - tanto para o bem quanto para o mal .
"Basicamente, capturamos esse evento de sinalização no ato, "disse o co-autor sênior do estudo Aashish Manglik, MD, Ph.D., um professor assistente de química farmacêutica na Escola de Farmácia da UCSF que conduziu o novo estudo como aluno de pós-graduação e bolsista ilustre em Stanford. "Esperamos que essas novas imagens em nível atômico nos permitam projetar racionalmente compostos que têm como alvo diferentes aspectos da sinalização de opióides no cérebro, com esperança de identificar novos, analgésicos mais seguros. "
O receptor opioide µ faz parte de uma grande família de centenas de proteínas de sinalização chamadas receptores acoplados à proteína G (GPCRs) que estão envolvidos em tudo, desde a visão e audição até a resposta do sistema imunológico a patógenos invasivos, e são o alvo de mais de 30 por cento dos medicamentos modernos. A maioria dos GPCRs compartilham os mesmos mecanismos básicos:Quando a molécula de sinalização certa (por exemplo, um opioide) se liga a um GPCR do lado de fora da célula, a proteína estimula uma reação em cadeia de sinais bioquímicos dentro da célula, ativando uma molécula mensageira chamada proteína G (daí o nome GPCR).
Experimentos que revelaram como um tipo diferente de GPCR se liga à proteína G "estimuladora" levaram ao Prêmio Nobel para Brian Kobilka, de Stanford, MD, um dos autores seniores do novo estudo, mas os pesquisadores sabem há décadas que os GPCRs também podem se ligar a até uma dúzia de outras moléculas de sinalização dentro da célula. Por exemplo, Receptores opióides µ tipicamente ativam apenas as chamadas proteínas G "inibitórias", que têm o efeito oposto da cascata de proteína G estimuladora. Contudo, os cientistas não têm certeza do que causa a afinidade de alguns GPCRs por proteínas parceiras específicas dentro da célula, ou exatamente quais são as consequências.
Os pesquisadores esperam que, ao compreender essas diferentes vias de sinalização GPCR, eles podem ser capazes de desenvolver drogas com efeitos altamente específicos, como suprimir a dor sem causar dependência. Mas até agora, os pesquisadores tinham pouca ideia de como um dado GPCR interage seletivamente com apenas um subconjunto de parceiros de sinalização dentro da célula.
O novo estudo, publicado em 13 de junho, 2018 em Natureza , capturou pela primeira vez como o receptor opióide µ se liga ao seu parceiro de proteína G inibitória. Entre outras descobertas, o estudo mostrou que a seletividade do receptor parece ser devido ao pequeno tamanho da bolsa de ligação para a proteína G no interior da célula, enquanto a proteína G estimuladora requer um sítio de ligação maior.
Manglik já havia colaborado anteriormente com o laboratório computacional de descoberta de drogas de Brian Shoichet, Ph.D., um professor de química farmacêutica na Escola de Farmácia da UCSF, para identificar uma molécula chamada PZM21 que permite que o receptor opioide µ envolva apenas a proteína G inibitória, mas não outra molécula sinalizadora chamada beta-arrestina, e mostrou que esta droga seletiva proporcionou alívio da dor com efeitos colaterais reduzidos em camundongos. Seu laboratório agora está construindo no novo, retrato de alta resolução do receptor opióide - complexo de proteína G para desenvolver novos, compostos ainda mais seletivos.