
Imagens de cristais de F420H2-oxidase obtidos aerobicamente com um tamanho típico de 0,1 mm. Com o oxigênio, o Fe e a flavina dentro da enzima dão a cor amarela natural aos cristais. Crédito:Instituto Max Planck de Microbiologia Marinha / T. Wagner
O metano é um poderoso gás de efeito estufa que desempenha um papel central no ciclo global do carbono. Ao mesmo tempo, é uma importante fonte de energia para nós, humanos. Cerca de metade de sua produção anual é feita por microorganismos conhecidos como metanógenos, que decompõem matéria orgânica, como plantas mortas. Isso normalmente ocorre em um habitat sem oxigênio, pois esse gás é letal para os metanógenos. Mas mesmo em habitats livres de oxigênio, moléculas de oxigênio aparecem ocasionalmente. Para tornar esses intrusos inofensivos, os metanógenos possuem uma enzima especial que é capaz de converter oxigênio em água.
"As enzimas são componentes vitais do metabolismo de todos os organismos vivos e o objetivo de nosso laboratório é entender como essas nanomáquinas estão trabalhando em nível molecular, "diz Tristan Wagner do Instituto Max Planck de Microbiologia Marinha e primeiro autor do estudo, publicado na revista científica Comunicação Química em setembro de 2020. Para o estudo, Wagner cultivou um microorganismo anaeróbio chamado Methanothermococcus thermolithotrophicus, que se originou do sedimento do Golfo de Nápoles. Ele purificou a enzima F420-oxidase, uma proteína flavodiiron, e o cristalizou, um método comum para estudar o funcionamento das enzimas.
“Já se sabia que a F420-oxidase pode converter oxigênio em água, "diz Wagner." Mas conseguimos decifrar o mecanismo. "O estudo é uma cooperação de cientistas do Instituto Max Planck de Microbiologia Marinha, o Instituto Max Planck de Microbiologia Terrestre, o Instituto Paul Scherrer, o Instituto de Pesquisa Interdisciplinar de Grenoble e o Centro Europeu de Radiação Síncrotron.
O oxigênio está bloqueado
O mecanismo, os pesquisadores revelaram, tem um requisito importante:o oxigênio é muito reativo, portanto, é crucial que a reação seja controlada corretamente pela enzima e que nenhum solvente esteja flutuando. Caso contrário, o oxigênio pode ser acidentalmente transformado em superóxido e matar o anaeróbio. O truque da enzima F420-oxidase é usar um canal de gás e um sistema de passagem. A molécula de oxigênio é primeiro canalizada no canal específico para uma cavidade catalítica anidra apropriada contendo ferro. Em seguida, o ferro transforma o oxigênio em água que será liberado por um mecanismo de passagem. Para isso a cavidade começa a se mover e abre uma pequena “porta”. Graças ao movimento, a água recém-gerada é transportada para fora. A cavidade vazia se fecha novamente e fica disponível para a próxima molécula de oxigênio.
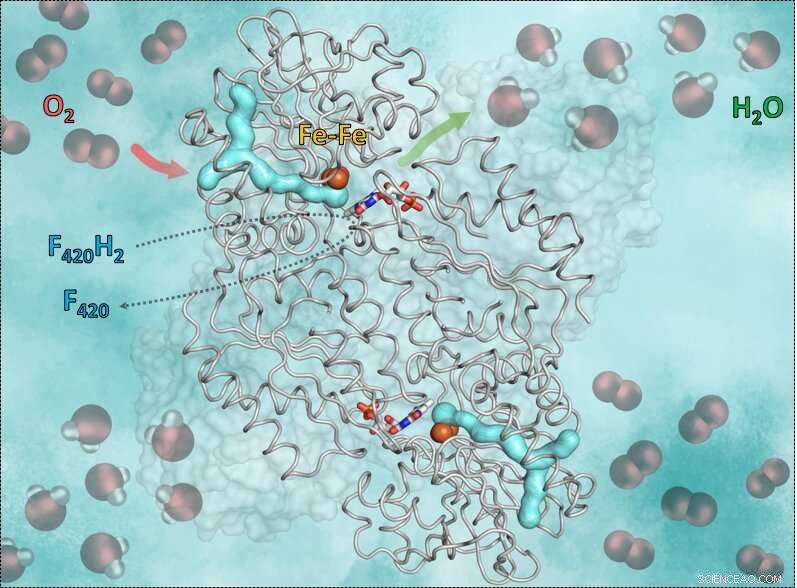
Este gráfico mostra a enzima F420H2-Oxidase e como ela funciona. A parte formada em y ciano é o canal de gás. A seta vermelha mostra o caminho do oxigênio para a cavidade catalítica contendo ferro. A seta verde simboliza a saída da água. Ainda, os bastões vermelho-azulados no meio mostram a flavina (FMN) aceitando elétrons da coenzima reduzida F420, que traz o hidrogênio necessário para converter o oxigênio em água. Crédito:S. Engilberge e T. Wagner
Para obter informações sobre esse mecanismo, os cientistas usaram a cristalografia de raios-X. Eles primeiro obtiveram a estrutura cristalina sem oxigênio, onde eles podiam ver a cavidade catalítica anidra isolada do solvente. Então, eles gasearam os cristais de enzima com o criptônio de gás inerte, que, ao contrário do oxigênio, pode ser tornado visível por raios-X. Posteriormente, eles irradiaram os cristais de enzima e foram capazes de detectar átomos de criptônio mostrando o canal de gás que conduz à cavidade catalítica. A proteína flavodiiron e seu canal são conservados não apenas em metanógenos, mas também em outros microorganismos como clostrídios (que vivem principalmente no solo ou no trato digestivo), nas bactérias sulfurosas Desulfovibrio gigas ou mesmo no parasita intestinal Giardia intestinalis.
Quanto mais rápido melhor
"Essa reação é muito rápida, "diz Sylvain Engilberge do Instituto Paul Scherrer e primeiro autor do estudo ao lado de Tristan Wagner." Esta velocidade também é a grande importância de nossa investigação. "Enzimas semelhantes como lacase são muito mais lentas." Para futura aplicação de eletroquímicos bioinspirados processos, precisamos aprender mais com a reação química, estrutura e função de diferentes grupos de enzimas redutoras de oxigênio, ", diz Engilberge. Também abriria o caminho da engenharia de proteínas para converter um desintoxicante de O2 de alta taxa em um reservatório de elétrons para processos industriais.
"Nosso próximo passo seria entender a diversidade da proteína flavodiiron, "diz Tristan Wagner. Alguns homólogos não têm como alvo o oxigênio, mas o venenoso óxido nítrico, suas enzimas podem discriminar entre os dois gases com alta especificidade. Mas qual é o filtro seletivo? O canal de gás? O ambiente da cavidade catalítica? “Mais estudos precisam ser realizados para entender como a proteína discrimina oxigênio e óxido nítrico, "acrescenta Wagner. Com esse conhecimento, seria, por exemplo, possível prever a partir de informações genômicas se uma proteína flavodiiron seria um limpador de oxigênio ou óxido nítrico.