S-glutationilação de Hsp70 induzível por humanos revela mecanismo regulatório envolvendo tampa α-helicoidal C-terminal
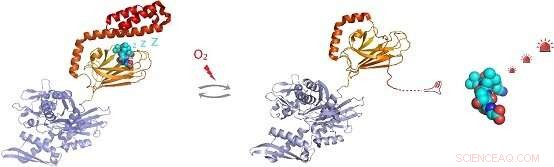 p Figura:Sob condições de estresse oxidativo, a chaperona molecular Hsp70 sofre modificação pós-tradução de resíduos de cisteína pela adição do tripeptídeo glutationa. A glutationilação dentro do domínio de ligação ao substrato de Hsp70 faz com que a região helicoidal C-terminal de Hsp70 se desfaça e ocupe seu próprio local de ligação ao substrato. Isso evita vinculação, permitindo a ativação de substratos de moléculas de sinalização, como o fator de transcrição de choque térmico Hsf1. Crédito:Grupo da Dra. Sarah Perrett
p Figura:Sob condições de estresse oxidativo, a chaperona molecular Hsp70 sofre modificação pós-tradução de resíduos de cisteína pela adição do tripeptídeo glutationa. A glutationilação dentro do domínio de ligação ao substrato de Hsp70 faz com que a região helicoidal C-terminal de Hsp70 se desfaça e ocupe seu próprio local de ligação ao substrato. Isso evita vinculação, permitindo a ativação de substratos de moléculas de sinalização, como o fator de transcrição de choque térmico Hsf1. Crédito:Grupo da Dra. Sarah Perrett
p Proteínas de choque térmico 70 (Hsp70) são uma família de chaperonas moleculares antigas e conservadas. Eles desempenham um papel essencial na manutenção da homeostase das proteínas, incluindo a facilitação do dobramento e degradação de proteínas, prevenindo a agregação de proteínas, e participando da resposta ao estresse. A interrupção da maquinaria de controle de qualidade celular está associada ao envelhecimento, câncer e doenças neurodegenerativas. p O papel das modificações pós-traducionais (PTMs) na regulação das funções de Hsp70 é um campo emergente de pesquisa. Embora o estresse oxidativo possa ser prejudicial, a variação redox é uma característica natural do ambiente celular e facilita a transdução de sinal para atividades fisiológicas importantes. As modificações das proteínas da cisteína fornecem o meio principal para a transferência do sinal redox. A glutationilação é uma modificação reversível de resíduos de cisteína em proteínas, que pode proteger as proteínas da oxidação irreversível, e também pode desempenhar um papel na transdução de sinal.
p Neste estudo, A glutationilação de diferentes membros da família Hsp70 foi detectada em células HeLa e os locais de modificação foram verificados por espectrometria de massa por pesquisadores da Prof. Sarah Perrett e do grupo do Prof. Chen Chang no Instituto de Biofísica da Academia Chinesa de Ciências.
p Com foco em Hsp70 HspA1A induzível por estresse (hHsp70), o mecanismo estrutural detalhado de como a glutationilação afeta a atividade da proteína e as interações proteína-proteína foi investigado.
p A detecção in vivo mostrou que cada um dos cinco resíduos de cisteína de hHsp70 pode sofrer glutationilação. Experimentos in vitro revelaram que a modificação de cisteínas no domínio de ligação de nucleotídeo de hHsp70 é evitada pela ligação de nucleotídeo, mas que Cys-574 e Cys-603, localizado na tampa helicoidal α C-terminal do domínio de ligação ao substrato, pode sofrer glutationilação na presença e ausência de nucleotídeo.
p Ao resolver a estrutura de NMR da forma glutationilada do hHsp70 SBD, a base estrutural para as mudanças funcionais foi demonstrada. A glutationilação desses resíduos de cisteína resulta no desdobramento da estrutura da tampa em hélice α. A região desdobrada imita o substrato ligando-se e bloqueando o local de ligação ao substrato, promovendo assim a atividade ATPase intrínseca, e competindo com a ligação de substratos externos. Isso leva a uma redução em sua capacidade de se ligar a outras proteínas de substrato, como o fator de choque térmico Hsf1.
p Esses resultados indicam não apenas que a modificação da cisteína pode alterar a estrutura e função de hHsp70, mas também que o hHsp70 pode transferir informações redox para seus clientes.
p Este estudo foi publicado no
Journal of Biological Chemistry em 12 de junho de 2020.
