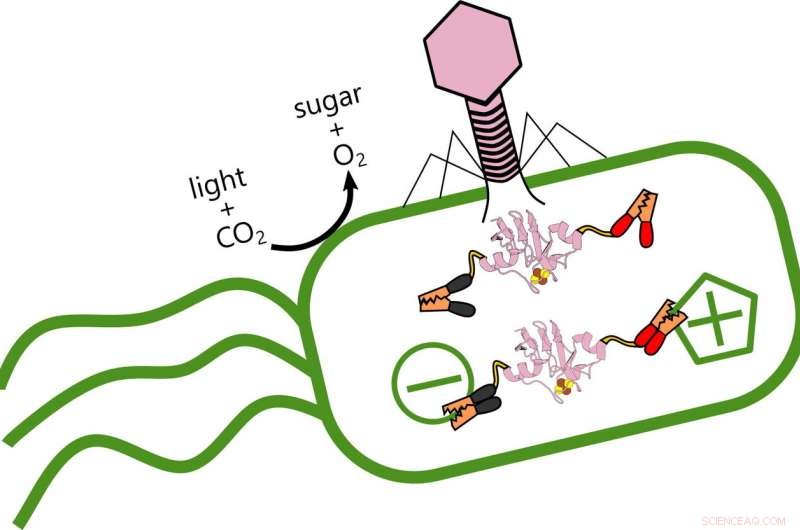
Os cientistas do arroz estão analisando o papel das proteínas ferredoxina produzidas quando os fagos virais alteram a transferência de elétrons nos oceanos. bactérias fotossintéticas que produzem oxigênio e armazenam carbono. Quando o vírus (rosa) infecta a bactéria, ele produz uma proteína ferredoxina que se liga à estrutura elétrica existente da bactéria e altera seu metabolismo. Crédito:Ian Campbell
Abaixo da superfície do oceano, um vírus está sequestrando o metabolismo do organismo mais abundante da Terra. Isso pode ser do interesse daqueles de nós que respiramos.
Os cientistas da Rice University analisaram o papel das proteínas ferredoxina produzidas quando os fagos alteram a capacidade de Prochlorococcus marinus de armazenar carbono e combater o efeito de gases do efeito estufa decorrente do consumo de combustível fóssil.
P. marinus é uma cianobactéria fotossintética que reside principalmente nos trópicos e subtrópicos, onde cerca de 10 a 27 (um octilhão) deles usam a luz do sol para produzir oxigênio e armazenar coletivamente quatro gigatoneladas de carbono anualmente. Parte desse carbono fornece matérias-primas essenciais para outros organismos marinhos.
Mas os fagos não são seus amigos. O vírus se fortalece roubando energia que a bactéria produz da luz, reprogramar o genoma de sua vítima para alterar a forma como transfere elétrons.
P. marinus e seu mecanismo de armazenamento de carbono são sensíveis à temperatura, por isso vale a pena observar enquanto a mudança climática aquece os oceanos e estende seu alcance, disse Ian Campbell, um pesquisador de pós-doutorado de Rice e principal autor do estudo no Journal of Biological Chemistry .
“O crescimento do alcance desse organismo nos oceanos pode aumentar o carbono total armazenado por esses micróbios, "ele disse." Alternativamente, os vírus que infectam essas bactérias podem alterar a fixação de carbono e, potencialmente, impedir que gigatoneladas de carbono sejam retiradas do ar anualmente, de acordo com uma projeção recente. "
Campbell disse que o objetivo do estudo é explorar a variedade de maneiras pelas quais os vírus interagem com seus hospedeiros. No processo, os pesquisadores descobriram que o fago arranca o controle do fluxo de elétrons no próprio hospedeiro, religar o metabolismo da bactéria. “Quando o vírus infecta, ele interrompe a produção das proteínas bacterianas e as substitui por suas próprias variantes, "ele disse." Eu comparo isso a colocar um sistema operacional diferente em um computador. "
Os pesquisadores usaram técnicas de biologia sintética para misturar e combinar proteínas de fago e cianobactérias para estudar como elas interagem. Uma parte do estudo liderado pelo bioquímico de Rice George Phillips também determinou pela primeira vez a estrutura de uma proteína chave de ferredoxina do cianófago.
"Um fago geralmente entra em uma célula e mata tudo, "disse o biólogo sintético de Rice, Jonathan Silberg, o principal cientista do estudo e diretor de Sistemas da universidade, Programa de Biologia Sintética e Física.
"Mas os resultados de Ian sugerem que esses fagos estão estabelecendo um mecanismo de controle complexo, "ele disse." Eu não diria que eles zombificaram seus hospedeiros, porque permitem que as células continuem fazendo algumas de suas próprias tarefas domésticas. Mas eles também estão conectando suas próprias ferredoxinas, como cabos de alimentação, para ajustar o fluxo de elétrons. "
Em vez de trabalhar diretamente com cianófagos e P. marinus, Campbell e sua equipe usaram ferramentas de biologia sintética para reprogramar muito mais, melhor compreensão da bactéria Escherichia coli para expressar genes que imitam as interações entre os dois.
"Pegando um fago e uma cianobactéria do oceano e tentando estudar a biologia, especialmente o fluxo de elétrons, seria muito difícil de fazer por meio da bioquímica clássica, "Silberg disse." Ian literalmente pegou parceiros tanto do fago quanto do hospedeiro, juntá-los codificando seu DNA em outro sistema celular, e foi capaz de desenvolver rapidamente alguns resultados interessantes.
"É uma aplicação interessante da biologia sintética para entender coisas complexas que de outra forma seriam difíceis de medir, " ele disse.
Os pesquisadores suspeitam que a proteína que modelaram em E. coli, a ferredoxina do fago Prochlorococcus P-SSM2, não é nada novo. "As pessoas sabiam que os fagos codificam coisas diferentes que fazem a transferência de elétrons, mas eles não sabiam como conectar os fios entre o fago e o hospedeiro, "Silberg disse." Eles também não sabiam muito sobre a evolução do fago. A estrutura deixa claro que este fago pode ser rastreado até proteínas ancestrais específicas envolvidas na fotossíntese. "