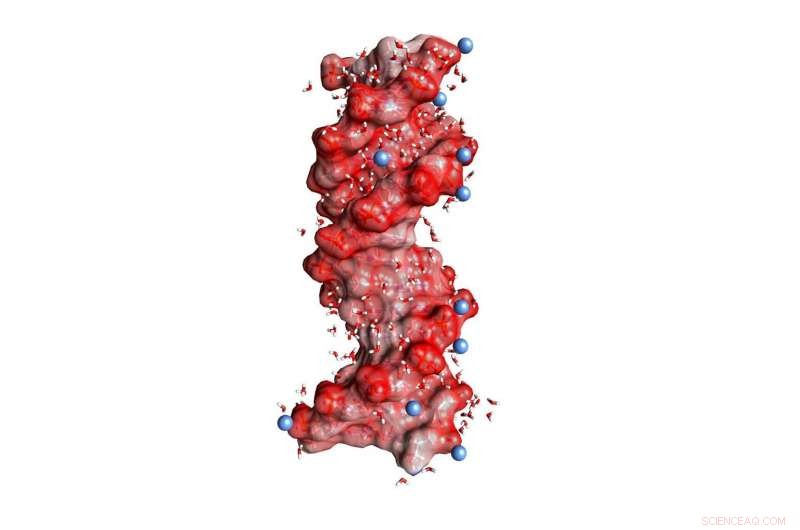
Fig. 1:DNA dupla hélice embutida em água (pequenas moléculas angulares, não escalar). As esferas vermelho-escuras na superfície da hélice representam átomos de oxigênio das unidades PO2- carregadas negativamente, as esferas azuis carregam íons positivamente no ambiente. Crédito:MBI Berlin
Pares de grupos fosfato carregados negativamente e íons de magnésio positivos representam uma característica estrutural chave do DNA e RNA embutidos na água. Vibrações de grupos de fosfato foram agora estabelecidas como sondas seletivas de tais pares de contato e permitem um mapeamento de interações e estrutura nas escalas de tempo ultrarrápidas da dinâmica molecular.
DNA e RNA são polímeros carregados que codificam informações genéticas em uma estrutura de dupla hélice e atuam como peças-chave na biossíntese de proteínas. Suas cargas negativas estão localizadas na estrutura molecular, que consiste em fosfato iônico (PO 2- ) e de grupos de açúcar (Figura 1). A estabilização das estruturas macromoleculares de DNA e RNA requer uma compensação de fortes forças elétricas repulsivas entre os grupos fosfato igualmente carregados por íons opostos, ou seja, carga positiva. Nesse contexto, magnésio (Mg 2+ ) Os íons são particularmente relevantes, pois não apenas estabilizam a estrutura, mas também medeiam o reconhecimento de parceiros de ligação externos e agem como centros catalíticos. Além disso, mudanças na estrutura macromolecular por meio de processos de dobramento dinâmico estão conectadas com um rearranjo de íons positivos embutidos na camada de água circundante.
Os íons positivos são arranjados em geometrias diferentes em torno do DNA e RNA:nas chamadas geometrias ligadas ao local ou pares de contato, um íon positivo está localizado em contato direto com um átomo de oxigênio de um grupo fosfato. Em contraste, a chamada atmosfera de íons externos consiste em íons positivos separados por pelo menos uma camada de moléculas de água dos grupos fosfato. O papel funcional das diferentes geometrias e as interações subjacentes estão longe de ser compreendidas. Uma visão mais profunda no nível molecular requer sondas altamente sensíveis que permitem discernir as diferentes geometrias de íons sem perturbá-los, e para mapear sua dinâmica na escala de tempo ultrarrápida dos movimentos moleculares.

Fig. 2:Topo:Estrutura molecular de um par de íons de contato consistindo de fosfato de dimetila (DMP) e um íon de magnésio Mg2 embebido em água. As setas marcam os alongamentos das ligações fósforo-oxigênio na vibração de alongamento PO2 assimétrico. Abaixo:espectros de infravermelho bidimensional (2D-IR) da vibração de alongamento PO2 assimétrica medida em um tempo de espera T =500 fs após a excitação vibracional. A resposta vibracional é mostrada em função da excitação infravermelha e das frequências de detecção e consiste em um componente P1 das moléculas DMP sem um íon de magnésio na vizinhança e na contribuição P2 dos pares de íons de contato. Este último é deslocado para frequências mais altas devido à interação entre PO2- e Mg2. Crédito:MBI Berlin
Em uma publicação recente, pesquisadores do Instituto Max Born (MBI) demonstram que as vibrações de grupos de fosfato representam sondas sensíveis e não invasivas de geometrias de íons em um ambiente aquático. Dimetilfosfato (DMP, (CH 3 O) 2PO 2- ), um sistema modelo estabelecido para a estrutura do DNA e RNA, foi preparado em água líquida com um excesso de Mg 2+ íons (Figura 2, topo) e estudado por espectroscopia vibracional não linear no domínio do tempo femtossegundo (1 fs =10 -15 s). Os experimentos fazem uso de espectroscopia infravermelha bidimensional (2-D-IR), um método mais sofisticado para analisar as interações iônicas e estruturas na escala de tempo intrínseca de movimentos moleculares flutuantes.
Os experimentos mapeiam Mg 2+ íons em contato direto com um PO 2- grupo por meio de um recurso distinto no espectro 2-D-IR (Figura 2, fundo). A interação com o Mg 2+ íon muda o PO assimétrico 2- alongamento da vibração para uma frequência que é maior do que na ausência de Mg 2+ íons. A forma de linha e a evolução temporal deste novo recurso revelam flutuações da geometria do par de íons de contato e a concha de água embutida em uma escala de tempo de centenas de femtossegundos, enquanto o próprio par de contato existe por muito mais tempo (~ 10 -6 s). Uma análise teórica aprofundada mostra que o equilíbrio sutil de forças eletrostáticas atrativas (Coulomb) e forças repulsivas devido à interação de troca mecânica quântica governam a posição de frequência da vibração de fosfato.
A capacidade da espectroscopia 2-D-IR de caracterizar a interação íon-fosfato de curto alcance em solução fornece uma nova ferramenta analítica que complementa as técnicas estruturais disponíveis atualmente. Uma extensão desta nova abordagem para DNA e RNA e seu ambiente iônico é mais promissora e espera-se que forneça novos insights sobre as forças que estabilizam as estruturas de equilíbrio e conduzem os processos de dobramento.