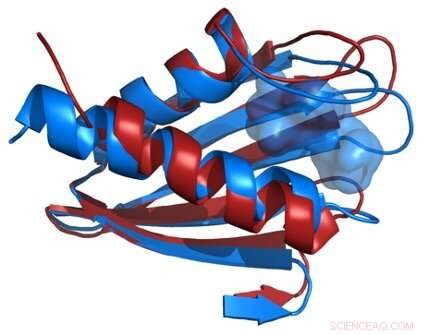
A comparação das estruturas da estrutura da proteína Flpp3 derivada de um laser de elétrons livres de raios-X (vermelho) e de NMR (azul) revela uma cavidade interna que é única para a estrutura de NMR e, portanto, sugere a existência de estruturas intermediárias de proteína. Crédito:James Zook
A tularemia é uma doença rara, mas geralmente letal. É causada por um dos patógenos mais agressivos da Terra, a bactéria Francisella tularensis. O micróbio, transportado por uma variedade de animais e insetos, é capaz de entrar e atacar o corpo através de uma série de vias, resultando em diferentes constelações de sintomas e graus de gravidade.
A tularemia permanece mal compreendida e não existe vacina segura e eficaz para a doença. A extrema letalidade de F. tularensis e seu potencial para ser aerossolizado também o tornaram um candidato a arma biológica, aumentando a urgência de compreender a doença e desenvolver tratamentos eficazes.
Em um novo estudo, pesquisadores do Biodesign Center for Applied Structural Discovery examinam uma proteína-chave da membrana responsável pela capacidade prodigiosa da bactéria de infectar o corpo e causar doenças. Este fator de virulência, conhecido como Flpp3, é examinado em detalhes sem precedentes com o auxílio de um laser de elétrons livres de raios-X ou XFEL, um acelerador de raios-X massivo e poderoso localizado no SLAC National Accelerator Laboratory, Stanford.
A tecnologia XFEL usa flashes brilhantes e extremamente curtos de raios-X para sondar amostras cristalizadas de Flpp3, revelando a estrutura detalhada da proteína como nunca antes. Ao comparar as informações estruturais coletadas por experimentos XFEL com a análise estrutural anterior usando NMR, pesquisadores desenvolveram um modelo mais completo da forma elaborada do Flpp3. (Estudos anteriores mostraram que quando um gene que codifica para Flpp3 é desativado, os efeitos do patógeno F. tularensis são significativamente diminuídos.)
Os cientistas esperam usar essas informações para desenvolver drogas direcionadas capazes de desativar as propriedades de virulência da proteína e proteger contra a tularemia. Os avanços na compreensão também podem ajudar os cientistas a desenvolver uma vacina eficaz contra a doença no futuro. Atualmente, existem apenas vacinas vivas atenuadas para tularemia, e os riscos de infecção e imunidade insuficiente associados a esta abordagem impediram o uso de tais vacinas nos Estados Unidos.
O pesquisador da Biodesign, Dr. James Zook, junto com os professores Petra Fromme e Abhishek Singharoy no Centro de Biodesign para Descoberta Estrutural Aplicada liderou o novo estudo. Ele é acompanhado por colegas internacionais, incluindo pesquisadores do DESY, SLAC, AstraZeneca, o Laboratório Europeu de Biologia Molecular em Grenoble, França, entre outros.
Petra Fromme, O diretor do Centro de Descoberta Estrutural Aplicada explica a importância dos resultados:"Este estudo combina, pela primeira vez, técnicas de XFEL de última geração com RMN e modelagem molecular para desvendar o grande espaço conformacional do Flpp3. O estudo desvenda diferentes conformações desta importante proteína para a virulência da bactéria na estrutura de XFEL e NMR, mostrando assim a natureza altamente dinâmica do Flpp3. Este estudo é tão emocionante, pois mostra que conformações muito diferentes coexistem e são convertidas umas nas outras sob condições fisiológicas. "
Visualizando virulência
Usando dados estruturais detalhados de NMR e nova análise XFEL do fator de virulência de tularemia, os pesquisadores identificaram um potencial inibidor do Flpp3. Essas informações foram obtidas em bibliotecas virtuais disponíveis contendo estruturas de fragmentos de medicamentos. Próximo, um método de modelagem baseado em física, conhecido como dinâmica molecular (MD), forneceu informações detalhadas sobre as flutuações e mudanças conformacionais de átomos e moléculas na proteína ligada à virulência, ajudando os pesquisadores a obter uma leitura mais precisa da estrutura e do comportamento do Flpp3.
"Este trabalho fornece várias estruturas de resolução atômica de um importante fator de virulência da bactéria que causa a tularemia, "de acordo com o pesquisador da Biodesign, Dr.Debra Hansen, um co-autor do novo estudo. As configurações de proteínas identificadas ajudarão os pesquisadores a buscar um projeto baseado na estrutura de drogas que podem ser eficazes contra a doença indescritível, através do direcionamento e inibição de Flpp3.
Como coautor e pesquisador da Biodesign, o Dr. Abhishek Singharoy explica, o estudo é notável por estar entre as primeiras investigações de flexibilidade conformacional de proteínas descobertas com cristalografia de raios X de femtossegundo serial e RMN e confirmadas por meio de simulações de dinâmica molecular (DM).
As descobertas do grupo aparecem na edição atual do jornal Cell Press Estrutura .
Ameaça persistente
Tularemia, também conhecida como febre do coelho, é uma doença infecciosa rara, normalmente atacando os olhos, pele, gânglios linfáticos e pulmões após infecção pela bactéria F. tularensis. A doença é endêmica na América do Norte, bem como em muitas partes da Europa e Ásia, embora os casos de tularemia sejam incomuns e os surtos generalizados tendam a se restringir a regiões com saneamento precário e inacessibilidade a serviços de saúde modernos.
A tularemia afeta principalmente mamíferos, particularmente roedores, coelhos e lebres, embora às vezes também infecte pássaros, ovelha, e animais domésticos, incluindo cachorros, gatos e hamsters.
A doença pode se espalhar para humanos por meio de picadas de insetos e exposição direta a um animal infectado. A doença é extremamente contagiosa. Apenas 10 células bacterianas podem ser fatais e uma única bactéria pode ser suficiente para causar infecção. O organismo pode viver semanas no solo, água e animais mortos.
A tularemia pode ser tratada de forma eficaz se detectada precocemente, embora o regime de tratamento possa ser longo e complexo. A maioria dos infectados com F. tularensis exibe sintomas dentro de três a cinco dias, embora possa demorar até duas semanas.
A doença existe em uma variedade de formas com sintomas diferentes, dependendo de como e onde as bactérias entram no corpo. Estes incluem tularemia ulceroglandular, a forma mais comum, que produz úlceras na pele no local da infecção, gânglios linfáticos inchados e doloridos, febre, arrepios, dor de cabeça e exaustão.
Outras formas incluem glandular, oculoglandular, orofaríngea, pneumônico, e tularemia tifóide. Se não for tratado, uma variedade de complicações graves da doença pode resultar, incluindo meningite, inflamação dos pulmões, irritação ao redor do coração e infecção óssea.
Método de cristal
No estudo atual, uma técnica conhecida como cristalografia de raios-X de femtosegundo serial é usada para sondar a estrutura da proteína Flpp3. Aqui, breves e brilhantes rajadas de raios-X, cerca de um bilhão de vezes mais brilhante do que os raios X convencionais, acertar um jato de cristais "voando" através do feixe de raios-X. A intensa explosão de raios-X destrói os cristais, mas antes de fazer isso, cria um padrão de difração em uma tela. Os pulsos de raios-X são ultracurtos, durando apenas 40 femtossegundos, que eles superam os danos de raios-X, permitindo que os dados sejam coletados em temperatura ambiente em condições quase fisiológicas. (1 fs =10 -15 segundos ou um quatrilionésimo de segundo.)
A montagem de muitas dessas tomadas de raios-X com o auxílio de computadores permite a montagem de uma Estrutura 3-D da proteína em estudo. Este método chamado difração antes da destruição foi pioneiro por Henry Chapman no Deutsches Elektronen-Synchrotron (DESY) com a equipe da ASU sob a liderança de John Spence e Petra Fromme e seus colaboradores.
Os pesquisadores combinaram os novos dados estruturais XFEL com seus estudos de NMR anteriores de Flpp3, observando dois estados distintos da proteína. As simulações de MD revelaram uma estrutura de cavidade interna que é transitória, sugerindo que Flpp3 sofre uma mudança conformacional sutil.
A abordagem abre a porta para o desenvolvimento de medicamentos direcionados para reduzir a letalidade da tularemia e exibe o poder das tecnologias combinadas para desvendar os detalhes da estrutura e dinâmica das proteínas.