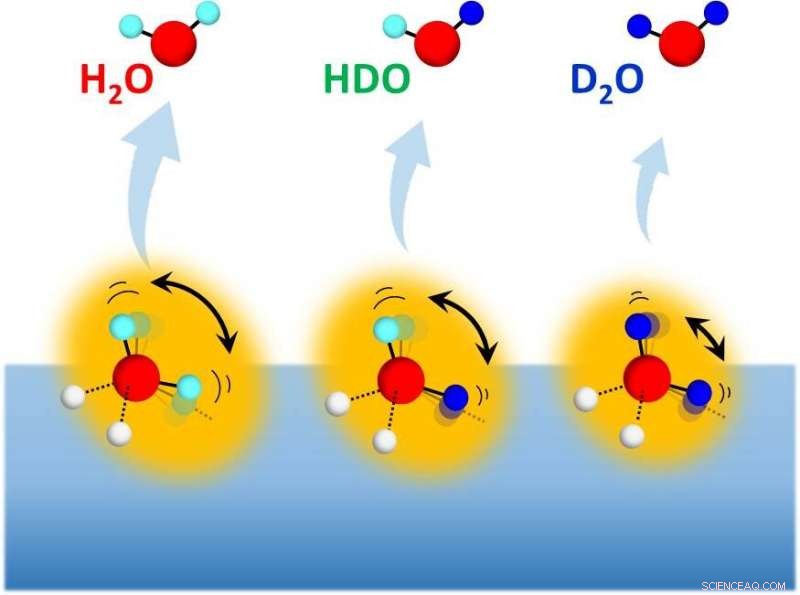
Desorção de isotopômeros de água (H 2 O, HDO e D 2 O) de superfícies de gelo misturado com isótopos com várias composições H / D. Crédito:NINS / IMS
A natureza quântica das ligações de hidrogênio na água se manifesta em efeitos isótopos físico-químicos peculiares:embora a deuteração frequentemente alongue e enfraqueça as ligações de hidrogênio de sistemas típicos de ligações de hidrogênio compostos de moléculas constituintes volumosas, alonga, mas fortalece as ligações de hidrogênio dos agregados moleculares da água. A origem desse efeito isotópico único das moléculas de água ainda precisa ser elucidada em nível molecular. Um estudo experimental recente sobre a sublimação de gelo de água com mistura de isótopos abordou essa questão.
As propriedades físico-químicas e biológicas dos sistemas ligados por hidrogênio são significativamente afetadas pelos efeitos quânticos nucleares, incluindo energias de ponto zero dos modos vibracionais, deslocalização de prótons, e efeito de tunelamento. Estes se originam da massa nuclear extremamente baixa de hidrogênio; portanto, os sistemas ligados por hidrogênio mostram notáveis efeitos isotópicos na deuteração. Na década de 1930, Ubbelohde primeiro propôs que a deuteração alonga e enfraquece as ligações de hidrogênio em muitos sistemas ligados por hidrogênio. Desde então, esse efeito isotópico foi amplamente confirmado e hoje é conhecido como efeito Ubbelohde. Em contraste, a deuteração das moléculas de água na água líquida e no gelo alonga, mas fortalece as ligações de hidrogênio. Apesar dos estudos experimentais e teóricos intensivos em mais de três quartos de século, a origem em nível molecular desse efeito isotópico peculiar nas ligações de hidrogênio da água não está clara.
Recentemente, pesquisadores liderados por Toshiki Sugimoto, professor associado do Institute for Molecular Science, resolveram o mistério de longa data:Como fazer D mais expandido 2 Os agregados O formam ligações de hidrogênio mais fortes do que H 2 Ó agregados, em contraste com os sistemas ligados por hidrogênio compostos de moléculas constituintes volumosas? Por meio de medições seletivas de isótopos na sublimação de gelo misturado com isótopos com várias composições isotópicas H / D, os pesquisadores fizeram uma nova descoberta para desvendar o mistério; o efeito do isótopo na força das ligações de hidrogênio é governado por dois efeitos de deuteração:(1) o efeito de fortalecimento da ligação derivado da energia do ponto zero do movimento rotacional impedido, e (2) o efeito de enfraquecimento (e alongamento) da ligação derivado do acoplamento anarmônico quântico entre os modos inter e intramolecular.
O conceito mais importante é que o efeito de deuteração (1) derivado do movimento rotacional desempenha papéis cruciais no processo de quebra de ligações de moléculas extremamente pequenas e leves. No caso de agregados de água, enorme diferença isotópica na energia do ponto zero da rotação prejudicada traz à tona uma natureza peculiar do efeito de fortalecimento da ligação (1) esmagador sobre o efeito de enfraquecimento da ligação (2), levando ao efeito isotópico único:as moléculas de água deuterada formam ligações de hidrogênio mais longas, porém mais fortes do que as moléculas de água hidrogenada. Em contraste, no caso de outros sistemas de ligações de hidrogênio típicos compostos de moléculas constituintes maiores e mais pesadas, como ácido oxálico di-hidratado, ácido benzóico, ácido succínico, e ciclohexano / Rh (111), as diferenças isotópicas na energia do ponto zero da rotação impedida são desprezivelmente pequenas. Portanto, apenas o efeito de enfraquecimento da ligação (2) é predominante no efeito do isótopo em sua energia de ligação, resultando em ligações de hidrogênio mais longas e fracas em sistemas deuterados do que em sistemas hidrogenados. Assim, as diferenças isotópicas na força das ligações de hidrogênio são determinadas por um equilíbrio delicado entre os dois efeitos de deuteração concorrentes (1) e (2), enquanto aqueles em comprimento de ligação de hidrogênio, ou seja, efeito de isótopo geométrico, são basicamente dominados pelo efeito de deuteração (2).
"Esses resultados e conceitos fornecem uma nova base para a nossa compreensão fundamental das ligações de hidrogênio da água altamente quânticas, "diz Sugimoto.