Crédito:McGill University
Pesquisadores da Faculdade de Medicina da Universidade McGill fizeram avanços importantes na compreensão do funcionamento das enzimas que desempenham um papel integral na produção de antibióticos e outras terapêuticas. Suas descobertas são publicadas em Ciência .
"Muitos dos medicamentos com os quais contamos hoje são produtos naturais, feito pela flora da Terra, "explica o Dr. Martin Schmeing, Professor Associado do Departamento de Bioquímica da McGill e autor sênior do estudo. "Isso inclui compostos produzidos em micróbios por enzimas massivas chamadas peptídeos sintetases não-ribossômicos, ou NRPSs. NRPSs sintetizam todos os tipos de antibióticos, que pode matar fungos e bactérias perigosos, bem como compostos para nos ajudar a combater infecções virais e cânceres. Por exemplo, estes compostos incluem viomicina, um antibiótico usado para o tratamento da tuberculose multirresistente; ciclosporina, que tem sido amplamente utilizado como imunossupressor em transplantes de órgãos; e o familiar antibiótico penicilina. "
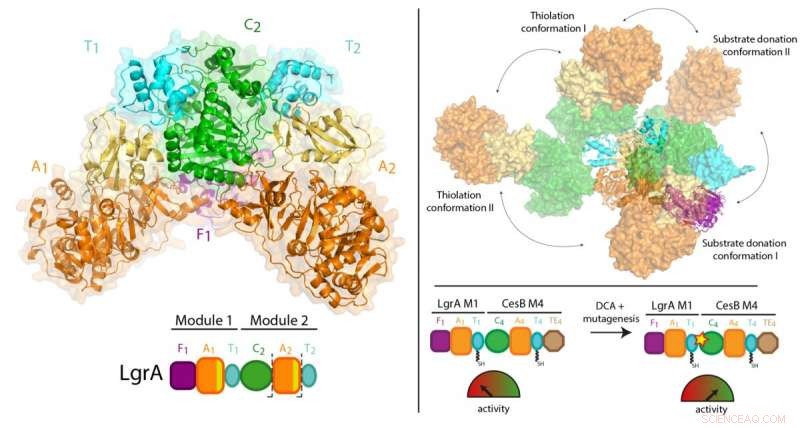
Para sintetizar essas drogas, NRPSs operam de forma semelhante a uma linha de montagem de fábrica, consistindo em uma série de estações de trabalho. Cada estação, chamado de "módulo, "tem fluxos de trabalho de várias etapas e peças móveis que permitem adicionar um componente de bloco de construção ao medicamento em crescimento.
Compreender o funcionamento interno da linha de montagem
O trabalho anterior do Dr. Schmeing e outros levou a uma compreensão sólida de como um módulo funciona. Agora, usando uma técnica chamada cristalografia de raios-X na fonte de luz canadense em Saskatchewan, e a Advanced Photon Source em Illinois, a equipe conseguiu tirar fotos 3D de altíssima resolução dos NRPSs.
Pela primeira vez, eles foram capazes de fazer observações de alta qualidade sobre como um módulo individual se relaciona com a linha de montagem maior, visualizando uma porção de dois módulos dos NRPSs que torna o antibiótico gramicidina linear (encontrado em tratamentos com Polisporina). O estudo encontrou uma surpreendente falta de sincronização entre os módulos em todos os pontos, exceto quando eles devem se coordenar para passar o intermediário de uma estação de trabalho para a próxima. Adicionalmente, eles descobriram que os módulos não se alinham em linha reta ou de outra forma organizada, mas, em vez disso, pode se alinhar em muitas posições relativas diferentes. "Esse nível de flexibilidade massiva não era esperado, "observa o Dr. Schmeing, que também é Diretor do Centro de Biologia Estrutural da McGill. "As enzimas estão fazendo ginástica."
Como as proteínas estão presas em um cristal, foi tomado cuidado para confirmar se os resultados eram representativos do que acontece na vida real. Dr. Schmeing trabalhou com seu colega, Dra. Alba Guarné, Professor do Departamento de Bioquímica da McGill, para usar dados de solução complementares, coletados na Advanced Light Source em Berkeley para validar as observações. "A comunidade de biologia estrutural é muito forte na McGill. Trabalhamos juntos para ajudar uns aos outros nas colaborações, para obter o equipamento biofísico necessário para experimentos de ponta, e para treinar nossos alunos ", diz o Dr. Schmeing, observando que os experimentalistas no papel, Janice Reimer, Max Eivaskhani e Ingrid Harb, são todos talentosos alunos de pós-graduação da McGill. "O meio ambiente e os colegas do Centro McGill de Biologia Estrutural são importantes para o sucesso contínuo de nossos laboratórios."
Implicações futuras para o projeto terapêutico
Os resultados podem ter implicações para a produção de novos antibióticos e terapêuticas a longo prazo. Desde que foram descobertos pela primeira vez, os cientistas estão entusiasmados com a possibilidade de fazer bioengenharia de NRPSs misturando e combinando estações de trabalho para produzir compostos de design. "Nosso estudo mostra que deve ser possível misturar e combinar esses módulos, mas que os NRPSs produzidos pela bioengenharia devem ser modificados nos pontos envolvidos na passagem do composto de um módulo para o próximo para que funcionem bem, "explica o Dr. Schmeing." Isto é algo que nos juntamos a Martin Weigt, da Sorbonne, para fazer uma prova de princípio no jornal, mas que precisará ser otimizado para a produção de terapias projetadas. "
"Estruturas de um peptídeo sintetase dimodular não ribossômico revelam flexibilidade conformacional, "por Reimer, J. M., Eivaskhani, M, Harb, EU., Guarne, UMA, Weigt, M., Schmeing, T. M. foi publicado na revista Ciência .