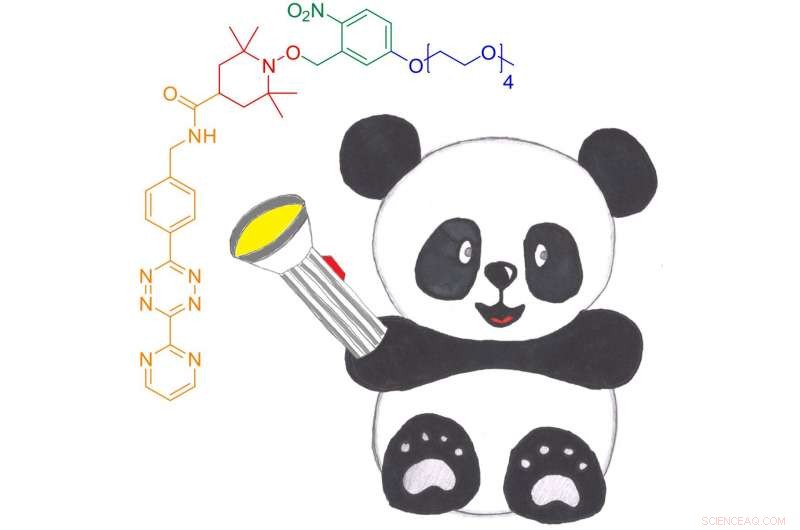
O novo nitróxido fotoativável para rótulo de spin de reação DAinv para proteínas, Panda. Ele pode ser ligado a proteínas por meio de uma cicloadição DAinv a aminoácidos não canônicos geneticamente codificados. Crédito:Anandi Kugele
A rotulagem direcionada ao local (SDSL) usada em combinação com a espectroscopia de ressonância paramagnética eletrônica (EPR) tem sido uma técnica testada e confiável para elucidar a estrutura, função e dinâmica de proteínas e complexos de proteínas. Rótulos de rotação à base de nitróxido estão entre os mais populares e mais bem estabelecidos porque são pequenos, não perturbador e exibe excelentes propriedades espectroscópicas. "Os procedimentos de rotulagem de rotação ideais exibem altas taxas de reação e seletividade, "explica o professor Malte Drescher, Professor de Espectroscopia de Sistemas Complexos do Departamento de Química da Universidade de Konstanz e principal autor do estudo ao lado do Professor Valentin Wittmann, que se especializou em síntese orgânica.
"Alcançar alta reatividade e alta seletividade ao mesmo tempo pode ser um problema, "continua Drescher." Com base em rótulos convencionais, por exemplo, em Gadolínio (III) ou tritil, exibem espectros muito amplos e profundidades de modulação baixas ou espectros muito estreitos que são inadequados para os tipos de experimentos que queremos conduzir. "Um novo estudo publicado por Drescher, Wittmann e sua equipe de químicos da Universidade de Konstanz, que foi publicado online no jornal Comunicações ChemBioChem em 14 de agosto de 2019, apresenta uma nova abordagem para rotular proteínas que apresenta marcadores de spin à base de nitróxido e aminoácidos não canônicos geneticamente codificados (ncAAs) como alvos para SDSL.
"Os nitróxidos fornecem largura espectral ideal e acesso a informações dinâmicas, "diz Anandi Kugele, pesquisador doutorado da Escola de Biologia Química de Konstanz (KoRS-CB) e primeiro autor do estudo, que recebeu uma bolsa de viagem de prestígio do National High Magnetic Field Laboratory para apresentar os resultados na Conferência das Montanhas Rochosas de 2019 sobre Ressonância Magnética em Denver, Colorado (EUA). "Rótulos tradicionais à base de nitróxido têm estabilidade redox limitada, o que é uma desvantagem para aplicativos dentro da célula. O desafio para nós era aumentar a estabilidade do nitróxido e, assim, adaptar os marcadores de spin à base de nitróxido para uso futuro de rotina in vivo. "Para esse fim, os pesquisadores desenvolveram um novo marcador de spin que pode ser anexado a proteínas por meio da cicloadição de Diels-Alder (DAinv) de demanda inversa de elétrons para ncAAs geneticamente codificados, um método que se provou adequado para uma ampla gama de aplicações in vitro e in vivo. Para alcançar a estabilidade do nitróxido, os pesquisadores usaram ainda uma estratégia de proteção baseada em grupos de proteção foto-removíveis, que são conhecidos por proteger os nitróxidos e liberá-los quando necessário.
O novo rótulo de spin - denominado nitróxido fotoativável para reação DAinv, ou PaNDA para breve - é solúvel em água, EPR-ativo e desprotegido com eficiência tanto in vitro quanto em testes de lisado com as duas proteínas modelo proteína fluorescente verde (GFP) e Escherichia coli oxidoredutase tioredoxina (TRX), que é encontrado em praticamente todos os organismos conhecidos, sugerir. "Precisamos melhorar o método usado para entregar o marcador de rotação PaNDA às células e testar as eficiências de rotulagem e desproteção dentro da célula, entre outras coisas, "conclui Malte Drescher:" Mas nossa pesquisa demonstra claramente que, em princípio, o rótulo PaNDA pode ser usado para medições EPR em ambientes biológicos desafiadores, incluindo o interior das células. Nossos testes com lisado de E. coli são muito promissores a esse respeito. Isso abrirá toda uma nova gama de oportunidades para o estudo de proteínas por meio da espectroscopia EPR. "