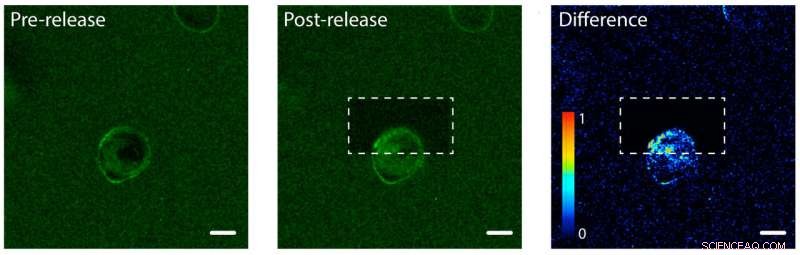
Fotorrelease de proteínas do fator de crescimento epidérmico (EGF) em um lado de uma célula humana. Esquerda:EGF (verde) está ligado a um hidrogel de uma única célula humana (centro). A membrana celular se liga ao EGF, tornando sua membrana verde. Meio:O hidrogel após usar um laser para desvincular e liberar proteínas EGF na parte superior da célula. À direita:uma imagem que mostra a diferença na cor verde fluorescente entre as imagens pós e pré-lançamento. Observe o aumento da cor na parte superior da célula, o que indica que a célula começou a internalizar as proteínas EGF não amarradas, mas apenas em um lado. A barra de escala é de 10 micrômetros. Crédito:Shadish, Benuska e DeForest, 2019, Materiais da Natureza
A engenharia de tecidos pode transformar a medicina. Em vez de esperar que nossos corpos cresçam novamente ou reparem os danos após uma lesão ou doença, cientistas podem se tornar complexos, tecidos totalmente funcionais em um laboratório para transplante em pacientes.
As proteínas são a chave para este futuro. Em nossos corpos, sinais de proteínas dizem às células para onde ir, quando dividir e o que fazer. No laboratório, cientistas usam proteínas para o mesmo propósito - colocar proteínas em pontos específicos ou dentro de estruturas projetadas, e então usar esses sinais de proteína para controlar a migração celular, divisão e diferenciação.
Mas as proteínas nesses ambientes também são frágeis. Para fazer com que eles grudem nos andaimes, os pesquisadores tradicionalmente modificam proteínas usando produtos químicos que matam mais de 90 por cento de suas funções. Em artigo publicado em 20 de maio na revista Materiais da Natureza , uma equipe de pesquisadores da Universidade de Washington revelou uma nova estratégia para manter as proteínas intactas e funcionais, modificando-as em um ponto específico para que possam ser quimicamente amarradas ao andaime usando luz. Uma vez que a corda também pode ser cortada por luz laser, este método pode criar padrões de evolução de proteínas de sinal em todo um andaime de biomaterial para fazer crescer tecidos compostos de diferentes tipos de células.
"As proteínas são os comunicadores definitivos de informações biológicas, "disse o autor correspondente Cole DeForest, professor assistente de engenharia química e bioengenharia da UW, bem como investigador afiliado do Instituto de Células Tronco e Medicina Regenerativa da UW. "Eles conduzem virtualmente todas as mudanças na função celular - diferenciação, movimento, crescimento, morte."
Por essa razão, os cientistas há muito empregam proteínas para controlar o crescimento e a diferenciação celular na engenharia de tecidos.
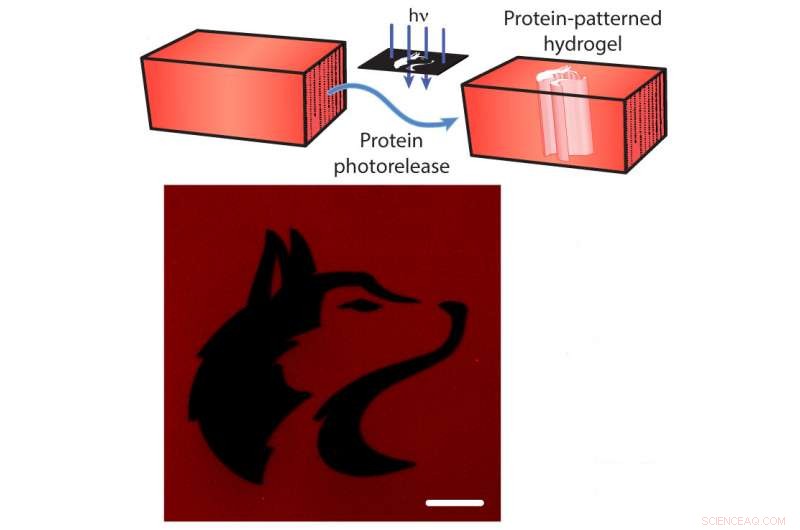
Fotorrelease de proteínas de um hidrogel. Superior:As proteínas fluorescentes vermelhas mCherry estão ligadas ao hidrogel. Os pesquisadores podem quebrar a corda com luz direcionada (setas azuis), liberando o mCherry do hidrogel (setas azuis). Abaixo:Uma imagem do hidrogel após a liberação do mCherry padronizada na forma do mascote da Universidade de Washington (preto). A barra de escala é de 100 micrômetros. Crédito:Shadish, Benuska e DeForest, 2019, Materiais da natureza.
"Mas os produtos químicos mais comumente usados pela comunidade para ligar proteínas a materiais, incluindo andaimes para engenharia de tecidos, destruir a esmagadora maioria de suas funções, "disse DeForest, que também é membro do corpo docente do UW Molecular &Engineering Sciences Institute. "Historicamente, pesquisadores tentaram compensar isso simplesmente sobrecarregando o andaime com proteínas, sabendo que a maioria deles estará inativa. Aqui, criamos uma maneira generalizável de funcionalizar biomateriais reversivelmente com proteínas, preservando sua atividade completa. "
A abordagem deles usa uma enzima chamada sortase, que é encontrado em muitas bactérias, para adicionar um pequeno peptídeo sintético a cada proteína de sinal em um local específico:o terminal C, um site presente em cada proteína. A equipe projeta esse peptídeo de forma que amarre a proteína de sinal em locais específicos dentro de um andaime de biomaterial cheio de fluido comum na engenharia de tecidos, conhecido como hidrogel.
Visar um único local na proteína de sinal é o que diferencia a abordagem da equipe UW. Outros métodos modificam proteínas de sinal anexando grupos químicos a locais aleatórios, que muitas vezes interrompe a função da proteína. Modificar apenas o terminal C da proteína é muito menos provável de interromper sua função, de acordo com DeForest. A equipe testou a abordagem em mais de meia dúzia de tipos diferentes de proteínas. Os resultados mostram que a modificação do terminal C não tem efeito significativo na função da proteína, e amarra com sucesso as proteínas em todo o hidrogel.
Sua abordagem é análoga a pendurar uma peça de arte emoldurada na parede. Em vez de martelar pregos aleatoriamente no vidro, tela e moldura, eles amarram um único fio na parte de trás de cada moldura para pendurá-la na parede.
Além disso, as amarras podem ser cortadas pela exposição à luz laser focada, causando "fotorrelocação" das proteínas. O uso deste sabre de luz científico permite que os pesquisadores carreguem um hidrogel com muitos tipos diferentes de sinais de proteínas, e, em seguida, expor o hidrogel à luz laser para desvincular proteínas de certas seções do hidrogel. Ao expor seletivamente apenas porções dos materiais à luz laser, a equipe controlou onde os sinais de proteína permaneceriam presos ao hidrogel.

Da esquerda para a direita:Cole DeForest, Gabrielle Benuska, Jared Shadish. Crédito:Dennis Wise / Universidade de Washington
Destacar proteínas é útil em hidrogéis porque as células podem, então, captar esses sinais, trazendo-os para o interior da célula, onde podem afetar processos como a expressão gênica.
A equipe de DeForest testou o processo de fotorrelease usando um hidrogel carregado com fator de crescimento epidérmico, um tipo de sinal de proteína. Eles introduziram uma linha celular humana no hidrogel e observaram os fatores de crescimento se ligando às membranas celulares. A equipe usou um feixe de luz laser para desvincular os sinais de proteína em um lado de uma célula individual, mas não o outro lado. No lado conectado da célula, as proteínas ficaram do lado de fora da célula, pois ainda estavam presas ao hidrogel. Do lado livre, os sinais de proteína foram internalizados pela célula.
"Com base em como direcionamos a luz laser, podemos garantir que diferentes células - ou mesmo diferentes partes de células individuais - estejam recebendo diferentes sinais ambientais, "disse DeForest.
Este nível único de precisão dentro de uma única célula não ajuda apenas na engenharia de tecidos, mas com pesquisa básica em biologia celular, adicionado DeForest. Os pesquisadores podem usar esta plataforma para estudar como as células vivas respondem a várias combinações de sinais de proteínas, por exemplo. Esta linha de pesquisa ajudaria os cientistas a entender como os sinais de proteínas funcionam juntos para controlar a diferenciação celular, curar o tecido doente e promover o desenvolvimento humano.
"Esta plataforma nos permite controlar com precisão quando e onde os sinais de proteínas bioativas são apresentados às células dentro dos materiais, "disse DeForest." Isso abre a porta para muitas aplicações interessantes em engenharia de tecidos e pesquisa terapêutica. "