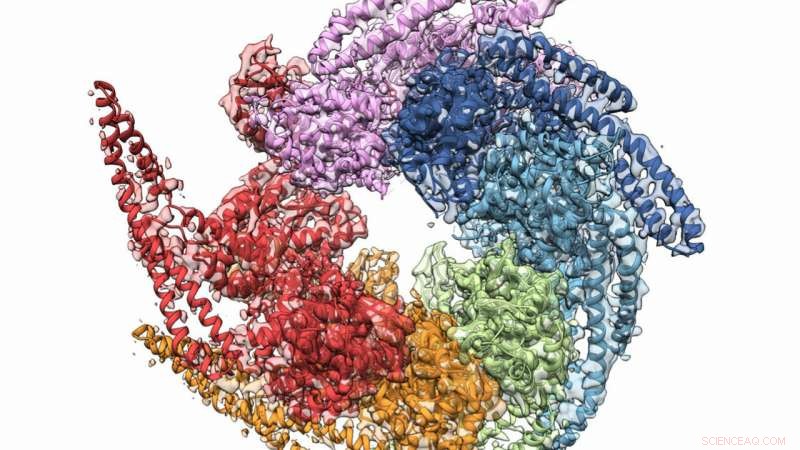
As estruturas combinadas de microscopia de cristal e crioeletron de Hsp104 desagregase do fungo Calcarisporiella thermophila . Crédito:Grigore Pintilie / Stanford University
Técnicas de raios-X e microscopia eletrônica ajudam a desvendar a história dos chaperones de proteínas.
Uma combinação de cristalografia de raios-X e microscopia crioeletrônica (crio-EM) auxiliou em um esforço colaborativo para obter a estrutura de maior resolução da proteína fúngica Hsp104, o que pode servir para impedir a formação de certas doenças degenerativas. O time, cujos membros incluíam pesquisadores do Laboratório Nacional de Argonne do Departamento de Energia dos EUA (DOE), também verificou uma estrutura helicoidal para os hexâmeros formados por proteínas, uma vez considerado plano. Os resultados foram publicados online no dia 27 de dezembro, Edição de 2018 de Estrutura .
Hsp104 é uma proteína hexamérica AAA + conhecida como chaperona, que ajuda nos processos naturais de dobramento de proteínas para o funcionamento adequado das células. Mais importante, possivelmente, esta classe de hexâmeros pode reparar proteínas mal dobradas ou agregadas que podem levar a anormalidades causadas por proteínas, como neurodegeneração.
Variantes desses chaperones são comuns entre organismos multicelulares, mas Hsp104 não tem homólogo entre humanos e outros animais. Embora seja mais robusto do que os chaperones derivados de humanos que podem falhar sob estresse celular, Hsp104 foi observado dobrando proteínas humanas.
"Fizemos alguns experimentos em que expressamos proteínas humanas em leveduras, o que torna o fermento doente porque eles se agregam. Mas se você expressar Hsp104, o do fungo Calcarisporiella thermophila , protege a levedura desta doença de agregação, "disse Argonne Distinto FellowAndrzej Joachimiak.
Joachimiak trabalhou com uma equipe composta por pesquisadores de Argonne, a Universidade de Chicago, Stanford University e a University of Pennsylvania para obter uma melhor compreensão da estrutura e função do Hsp104.
A equipe se voltou para a Fonte Avançada de Fótons de Argonne, um DOE Office of Science User Facility, para sondar a estrutura da proteína usando cristalografia de raios-X. Eles examinaram 30 amostras diferentes, incluindo 14 chaperones Hsp104 de diferentes fontes. Nesse processo, um único cristal foi mergulhado em nitrogênio líquido e submetido a raios-X duros a partir dos quais os padrões de difração foram coletados e a estrutura reconstruída. Apenas a proteína do Calcarisporiella fungo difratado em alta resolução, observou Joachimiak.
Para entender melhor a relação estrutural da proteína dentro de uma célula viva, em seguida, eles se voltaram para uma investigação da proteína em solução. As amostras foram selecionadas usando microscopia eletrônica na Universidade de Chicago e, em seguida, enviadas para a Universidade de Stanford, onde os microscópios crioeletrônicos coletaram os dados moleculares de alta resolução necessários para determinar a estrutura por meio de computação complexa. Tal como acontece com a investigação do cristal, a Calcarisporiella amostra forneceu a melhor resolução.
Agora armado com a mais alta resolução de Hsp104 na forma de cristal e em solução, a equipe foi capaz de fazer determinações previamente desconhecidas ou incertas sobre as características e comportamentos da proteína.
Antes da descoberta da equipe, os biólogos acreditavam que o Hsp104 suportava cinco domínios, seções independentes da proteína que servem a funções específicas. Mas as novas estruturas de alta fidelidade não revelaram apenas quatro domínios, mas uma imagem mais clara de como eles se relacionam.
O domínio do terminal N, por exemplo, acredita-se que se ligue a uma proteína mal dobrada e a ajude a se desdobrar em uma forma linear. Isso permite que ele passe por um canal central estreito no hexâmero criado por dois domínios AAA (ATPases associadas a várias atividades celulares). A proteína é guiada, ou translocado, através deste canal para o outro lado do hexâmero, onde agora tem uma nova oportunidade de dobrar corretamente.
"As pessoas já haviam afirmado que outro, o domínio do terminal C, foi essencial para a formação do hexâmero, mas mostramos que isso não é verdade, "disse Joachimiak.?" Não interage com outras subunidades, mas pode funcionar como uma área de encaixe para outras acompanhantes para ajudar a redobrar as proteínas. "
Outra descoberta importante ajudou a mudar uma crença de longa data de que os hexâmeros do Hsp104 eram planos. Ambos os métodos de investigação provaram inequivocamente que são helicoidais, ajudando os pesquisadores a entender como o acompanhante forma o canal de "reparo".
A equipe planeja continuar explorando os muitos e variados acompanhantes que existem fora do genoma humano. Eles acreditam que esses acompanhantes podem servir como uma estratégia terapêutica com o potencial de literalmente desvendar proteínas que podem levar a doenças graves.
"É possível que existam outros acompanhantes por aí que sejam melhores do que os nossos, e que serão capazes de tratar proteínas que se agregam no cérebro e causam doenças, "disse Joachimiak.?" Isso seria realmente fantástico. "
O papel, "Estrutura de Calcarisporiella thermophila Hsp104 desagregase que antagoniza diversos eventos proteotóxicos de mal dobramento, "aparece na edição online de 27 de dezembro da revista Estrutura . Além de Joachimiak, A pesquisadora da Argonne, Karolina Michalska, contribuiu para este estudo.