
Crédito:Universidade de Leiden
Depois de quase quatro décadas, Os químicos de Leiden e Eindhoven resolveram a discussão sobre o modelo correto em relação à reação química mais simples em catálise heterogênea, que é essencial para células de combustível. Usando uma superfície curva única de platina, Ludo Juurlink e Ph.D. o candidato Richard van Lent de Leiden e Michael Gleeson de DIFFER mostraram qual modelo descreve corretamente a reação do hidrogênio. Eles publicaram suas descobertas em Ciência em 11 de janeiro.
Por quase quatro décadas, tem havido um acalorado debate na literatura química:qual dos dois modelos existentes para a reação do hidrogênio a um catalisador de platina é o correto (veja o quadro)? Os métodos tradicionais não foram suficientes para provar isso. O químico de Leiden Ludo Juurlink e Michael Gleeson, do Instituto Holandês para Pesquisa de Energia Fundamental (DIFFER), decidiram desenvolver um novo método para fornecer evidências conclusivas, que acabou sendo um sucesso.
Os dois modelos existentes para catálise heterogênea fornecem previsões diferentes sobre como a reação do hidrogênio depende da estrutura da superfície da platina. Por meio de medições, os pesquisadores puderam determinar a reatividade do hidrogênio e, assim, comprovar qual modelo é o correto. O cristal curvo de platina foi crucial para isso, que foi feito pela empresa holandesa em Zaandam pela primeira vez. "Como a superfície da platina é curva, a estrutura atômica muda muito gradualmente ao longo da superfície, "explica Juurlink." Você pode comparar esta estrutura a uma escada, cujos passos em direção às bordas se tornam cada vez mais estreitos. No meio, parece mais um salão de baile. "Descobriu-se que a reatividade do hidrogênio era linearmente dependente da proximidade das etapas. Quanto mais distantes as etapas estavam, o hidrogênio menos reativo era. "E então o modelo que previu um comportamento não linear está incorreto, " ele diz.
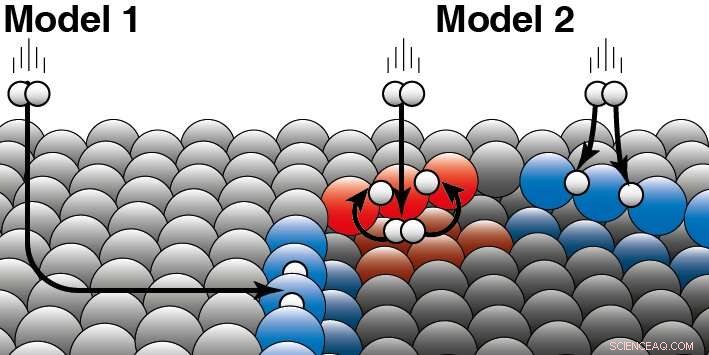
Um catalisador acelera uma reação química sem ser consumido. Na catálise heterogênea, o catalisador é geralmente um sólido e os reagentes um gás ou líquido. Juurlink explica a diferença entre os dois modelos:'Os dois modelos são baseados em suposições diferentes sobre como a energia cinética da molécula de hidrogênio' vaza 'durante a colisão com a superfície da platina.' Para esclarecer isso, ele dá um exemplo:'Se um cachorro está em um buraco no gelo, ele pode ter ido parar lá de duas maneiras. Ou ele escorregou do lado do gelo e caiu no buraco de gelo, ou ele pulou diretamente no buraco de gelo pela lateral. ' Sua pesquisa agora mostra que as moléculas de hidrogênio reagem principalmente fora da fase gasosa na borda do degrau da platina (Modelo 2). Modelo 1, Isso pressupõe que a maioria das moléculas acabam nas bordas 'patinando' sobre a superfície plana de platina e só então reagem, portanto, não é correto. Os pesquisadores viram diferenças entre os dois tipos diferentes de bordas (vermelho e azul) que ocorrem naturalmente nos catalisadores de platina. O hidrogênio pode pousar na parte superior ou inferior dessa borda. Para ambos os tipos de bordas de degrau, os pesquisadores são capazes de decidir qual parte reage diretamente no lado superior (como ilustrado em azul) ou primeiro cai no lado inferior (como em vermelho). Crédito:Universidade de Leiden
A pesquisa foi conduzida em ultra-alto vácuo e fornece informações importantes. "Agora sabemos melhor como calcular a velocidade das reações químicas - um dos modelos não contribui significativamente, "diz Juurlink." Além disso, agora sabemos que essas superfícies curvas de cristal oferecem uma forma única, nova oportunidade de aprender como as reações químicas realmente ocorrem nas superfícies. Certamente vamos fazer mais pesquisas sobre isso. "
Quase todos os principais processos industriais químicos usam catálise heterogênea. Catalisadores às vezes são caros e raros, como platina, um catalisador comum encontrado em células de combustível e sistemas de escapamento de automóveis. "O incomum é que geralmente nem sabemos realmente como e por que esses catalisadores aceleram as reações químicas, "diz Juurlink. Uma melhor compreensão sobre como e por que contribuirá para tornar a indústria química mais sustentável." Com base em uma melhor compreensão do que está acontecendo no nível atômico, podemos desenvolver novos catalisadores, " says Juurlink. "Catalysts that cause less energy loss and are less dependent on expensive and rare materials."