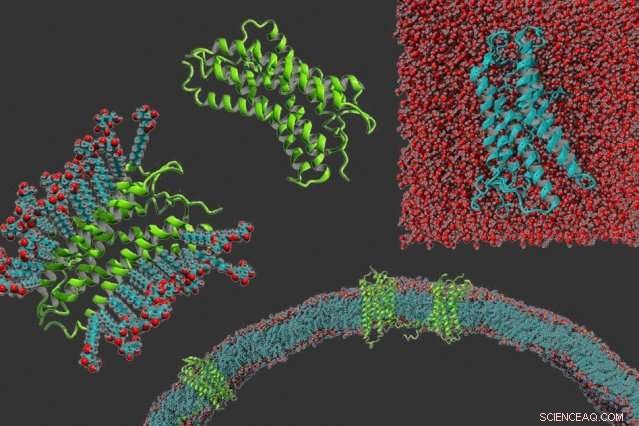
No sentido horário a partir da esquerda:um receptor acoplado à proteína g em detergente, a proteína por conta própria, um receptor acoplado à proteína g que se tornou solúvel em água, e receptores acoplados à proteína g embutidos em uma membrana. Crédito:Michael Skuhersky
Cerca de 30 por cento das proteínas codificadas pelo genoma humano são proteínas de membrana - proteínas que se estendem pela membrana celular para que possam facilitar a comunicação entre as células e seu ambiente. Essas moléculas são críticas para o aprendizado, vendo, e sentir odores, entre muitas outras funções.
Apesar da prevalência dessas proteínas, os cientistas tiveram dificuldade em estudar suas estruturas e funções porque as porções ligadas à membrana são muito hidrofóbicas, então eles não podem ser dissolvidos na água. Isso torna muito mais difícil fazer análises estruturais, como a cristalografia de raios-X.
Num avanço que pudesse facilitar a realização deste tipo de estudo estrutural, Os pesquisadores do MIT desenvolveram uma maneira de tornar essas proteínas solúveis em água, trocando alguns de seus aminoácidos hidrofóbicos por hidrofílicos. A técnica é baseada em um código que é muito mais simples do que os métodos desenvolvidos anteriormente para tornar essas proteínas solúveis, que dependem de algoritmos de computador que devem ser adaptados a cada proteína caso a caso.
"Se não houver regra a seguir, é difícil para as pessoas entenderem como fazer isso, "diz Shuguang Zhang, um dos principais cientistas pesquisadores do Centro de Bits e Átomos do MIT Media Lab. "A ferramenta tem que ser simples, algo que qualquer pessoa pode usar, não uma simulação de computador sofisticada que apenas algumas pessoas sabem como usar. "
Zhang é o autor sênior do estudo, que aparece no Proceedings of the National Academy of Sciences na semana de 27 de agosto. Outros autores do MIT são o ex-professor visitante Fei Tao, pós-doutorado Rui Qing, ex-professor visitante Hongzhi Tang, estudante de graduação Michael Skuhersky, ex-estudante Karolina Corin '03, SM '05, Ph.D. '11, ex-pós-doutorado Lotta Tegler, estudante de graduação Asmamaw Wassie, e o ex-aluno de graduação Brook Wassie '14.
Um código simples
Dos aproximadamente 8, 000 proteínas de membrana conhecidas encontradas em células humanas, cientistas descobriram estruturas para cerca de 50. Elas são amplamente vistas como muito difíceis de trabalhar porque, uma vez que são extraídas da membrana celular, eles só mantêm sua estrutura se estiverem suspensos em um detergente, que imita o ambiente hidrofóbico da membrana celular. Esses detergentes são caros, e não existe um detergente universal que funcione para todas as proteínas de membrana.
Zhang começou a trabalhar em uma nova maneira de lidar com esse problema em 2010, inspirado pelo falecido Alexander Rich, um professor de biologia do MIT. Rich levantou a questão de saber se as estruturas de proteínas chamadas hélices alfa, que constituem a maior parte da porção de proteínas embutida na membrana, pode ser mudado de hidrofóbico para hidrofílico. Zhang imediatamente começou a trabalhar nas soluções possíveis, mas o problema se mostrou difícil. Nos últimos oito anos, ele teve vários alunos e pesquisadores visitantes ajudando a trabalhar em sua ideia, mais recentemente Qing, quem alcançou o sucesso.
A ideia chave que permitiu a Zhang desenvolver o código é o fato de que alguns aminoácidos hidrofóbicos têm estruturas muito semelhantes a alguns aminoácidos hidrofílicos. Essas semelhanças permitiram que Zhang elaborasse um código em que a leucina é convertida em glutamina, isoleucina e valina são convertidas em treonina, e a fenilalanina é convertida em tirosina.
Outro fator importante é que nenhum desses aminoácidos é carregado, portanto, trocá-los parece ter um efeito mínimo na estrutura geral da proteína. Na verdade, isoleucina e treonina são tão semelhantes que os ribossomos, as estruturas celulares que montam proteínas, ocasionalmente insira o errado - cerca de uma vez em cada 200 a 400 ocorrências.

O pós-doutorado Rui Qing e o cientista pesquisador principal Shuguang Zhang lideraram o esforço para encontrar uma maneira simples de tornar as proteínas ligadas à membrana solúveis em água. Crédito:Jun Ni
Os pesquisadores chamam seu código de código QTY, após as três letras que representam a glutamina, treonina, e tirosina, respectivamente.
Em seus primeiros esforços para implementar este código, os pesquisadores substituíram apenas uma pequena fração dos aminoácidos hidrofóbicos embutidos na membrana, mas as proteínas resultantes ainda precisavam de um pouco de detergente para se dissolver. Eles aumentaram a taxa de substituição para cerca de 50 por cento, mas as proteínas ainda não eram totalmente solúveis em água, então eles substituíram todas as instâncias de glutamina, isoleucina, valina, e fenilalanina embutida nas membranas. Desta vez, eles alcançaram sucesso.
"Somente quando substituímos todos os resíduos hidrofóbicos nas regiões transmembrana é que podemos obter proteínas que são estáveis e completamente livres de detergente em um sistema aquoso, "Qing diz.
Semelhanças estruturais
Neste estudo, os pesquisadores demonstraram sua técnica em quatro proteínas que pertencem a uma classe de proteínas conhecida como receptores acoplados à proteína G. Essas proteínas ajudam as células a reconhecer moléculas, como hormônios, ou moléculas imunes, chamadas quimiocinas, e desencadeia uma resposta apropriada dentro da célula.
Joel Sussman, um professor de biologia estrutural no Instituto de Ciência Weizmann, descreveu o novo método como "incrivelmente simples e elegante".
"Embora vários cientistas tenham tentado encontrar uma maneira de 'solubilizar' receptores acoplados à proteína G e outras proteínas integrais de membrana, até agora, seus métodos não eram de uso geral e muitas vezes envolviam métodos computacionais muito complexos que não seriam amplamente aplicáveis, "diz Sussman, que não participou da pesquisa.
Os pesquisadores ainda estão trabalhando para obter as estruturas precisas dessas proteínas usando cristalografia de raios-X ou ressonância magnética nuclear (RMN), mas eles realizaram alguns experimentos que sugerem que as estruturas são semelhantes. Em um, eles mostraram que as proteínas solúveis em água desnaturam quase à mesma temperatura que as versões originais das proteínas. Eles também mostraram que as proteínas modificadas se ligam às mesmas moléculas-alvo às quais as proteínas originais se ligam, embora não tão fortemente.
Ser capaz de sintetizar versões solúveis em água dessas proteínas pode permitir novas aplicações, como sensores que podem detectar poluentes ambientais, dizem os pesquisadores.
Outra possibilidade é projetar versões solúveis em água das proteínas que se ligam a moléculas normalmente expressas por células cancerosas, que poderia ser usado para diagnosticar tumores ou identificar células cancerosas metastáticas em amostras de sangue, Zhang diz. Os pesquisadores também podem criar moléculas solúveis em água nas quais um receptor ligado à membrana ao qual os vírus normalmente se ligam está ligado a parte de um anticorpo. Se essas "terapias de engodo" fossem injetadas no corpo, os vírus se ligariam aos receptores e, em seguida, seriam eliminados pelo sistema imunológico, que seria ativado pela porção de anticorpo.