
A imagem de microscopia eletrônica revela a presença de muitas vesículas interconectadas, que parecem se comportar como portadores de colágeno (indicado por setas). Crédito: Comunicações de pesquisa bioquímicos e biofísicos
Pesquisadores do Instituto de Tecnologia de Tóquio (Tokyo Tech) identificaram uma enzima que controla a quantidade de secreção de células de colágeno. Como o desequilíbrio do colágeno está ligado a uma série de doenças humanas, o estudo fornece pistas para novas estratégias terapêuticas. Além disso, as descobertas podem facilitar a produção eficiente de colágeno para os alimentos, indústrias cosméticas e farmacêuticas.
Todas as células produzem e liberam proteínas. As proteínas são embaladas como "carga" em minúsculas, vesículas em forma de bolha antes de serem transportadas para fora da célula. Este processo, conhecido como secreção, é vital para um crescimento e desenvolvimento saudáveis.
Embora muitos estudos tenham mostrado como essas vesículas, chamadas transportadoras COPII, lidar com cargas de tamanho relativamente pequeno, poucos se concentraram no funcionamento de portadores incomumente grandes, conhecidos por empacotar proteínas muito grandes, como o colágeno.
Agora, um estudo realizado por pesquisadores, incluindo Masayuki Komada, Toshiaki Fukushima e o estudante de graduação Kohei Kawaguchi no Instituto de Tecnologia de Tóquio identificaram a USP8 como uma enzima chave envolvida no controle da formação de grandes portadores de colágeno. Eles relataram suas descobertas no jornal Comunicações de pesquisa bioquímicos e biofísicos .
A equipe mostrou que "ligar" o USP8 inibiu a formação de grandes portadores, e, assim, reduziu a secreção de colágeno. Por outro lado, desligando o USP8 do transporte de colágeno promovido, o que levou ao aumento da secreção de colágeno. (Veja as Figuras 1-3.)
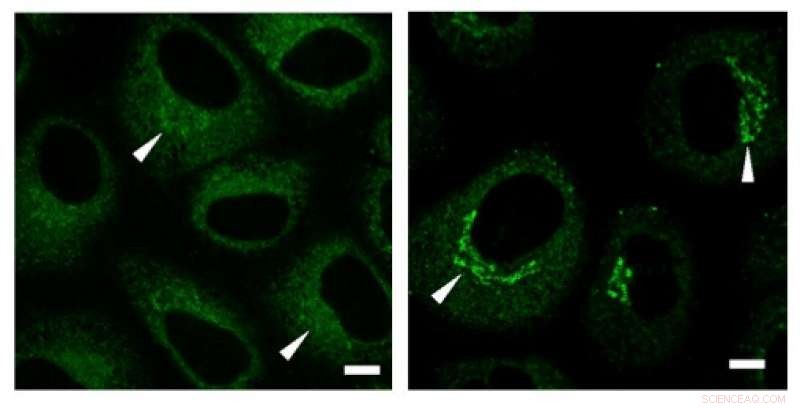
Experimentos de imunocoloração revelaram uma alta concentração de colágeno (sinais verdes) na região de Golgi antes da secreção. Crédito: Comunicações de pesquisa bioquímicos e biofísicos
As descobertas têm grandes implicações para a medicina e a biotecnologia. A secreção excessiva de colágeno no corpo humano é conhecida por causar fibrose de órgãos, enquanto a secreção de colágeno muito pequena está associada a doenças ósseas, incluindo displasia cranio-lentículo-sutural (CLSD) e síndrome de Cole-Carpenter. Novos tratamentos para essas doenças podem ser desenvolvidos por meio de uma maior compreensão do modo de ação exato da USP8. Esse conhecimento também pode fornecer novas maneiras de aumentar a produção comercial de colágeno.
Os pesquisadores demonstraram que a enzima atua desubiquitinando uma proteína chamada Sec31A, um componente do revestimento da vesícula COPII necessário para a exportação de proteínas.
Um grupo particular de proteínas, denominado complexo USP8-STAM1, parece ser responsável pela desubiquitinação de Sec31A, conforme ilustrado na Figura 3.
O estudo se baseia em muitos anos de pesquisas que iluminaram a versatilidade da USP8.
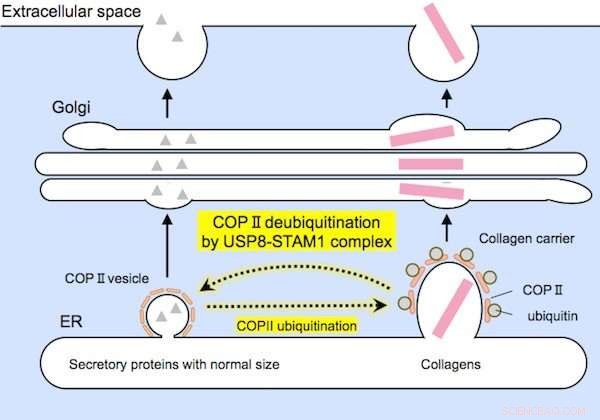
Proteínas de tamanho relativamente pequeno (à esquerda) e grandes colágenos (à direita) são encapsulados por portadores de COPII de tamanhos adequados antes da secreção. O complexo USP8-STAM1 inibe a formação de grandes transportadores de colágeno. Crédito: Comunicações de pesquisa bioquímicos e biofísicos
"Havíamos relatado anteriormente que o USP8 regula a secreção de hormônios hipofisários, "diz Fukushima, referindo-se a um artigo publicado em Nature Genetics em 2015. "No processo desse estudo, descobrimos acidentalmente que o complexo USP8-STAM1 se liga ao Sec31. "
Foi esta descoberta "acidental", combinado com resultados promissores de outros grupos nos EUA, que levou a equipe a examinar o papel da USP8 na formação dos portadores da COPII.
Em pesquisas que remontam a mais de uma década, Komada e outros esclareceram o papel convencional da USP8 na regulação da endocitose5. "É muito interessante que o mesmo complexo USP8-STAM1 agora tenha demonstrado desempenhar um papel importante tanto na regulação da endocitose quanto na secreção, "Fukushima diz.
O presente estudo, portanto, revela uma "nova face" da enzima USP8, e Fukushima sugere que pode haver mais surpresas por vir. USP8 pertence a uma família de cerca de 90 enzimas desubiquitinantes conhecidas, que continuam a ser um tópico quente na biologia celular.