
Fig.1 Produção de fenol usando bactérias. Crédito:Osami Shoji e Masayuki Karasawa
Pesquisadores da Universidade de Nagoya usam E. coli para converter benzeno em fenol, simplificando uma reação química que é difícil por métodos convencionais
Romper as ligações carbono-hidrogênio é notoriamente difícil em química de laboratório, no entanto, a natureza o faz sem esforço. Agora, os cientistas usaram a bactéria E. coli para oxidar as ligações C – H no benzeno para gerar fenol, com uma enzima inserida geneticamente (citocromo P450BM3), que evoluiu originalmente para atingir outras moléculas, ácidos graxos de cadeia longa.
Fazer com que as enzimas façam novas reações - sequestrando efetivamente a bioquímica das células vivas para nossos próprios propósitos - é geralmente complicado, envolvendo condições adversas ou modificação genética das próprias enzimas.
Contudo, pesquisadores da Universidade de Nagoya resolveram isso usando moléculas "iscas", que imitam os alvos nativos (substratos) de enzimas de ocorrência natural, para ativar a reação desejada.
Conforme relatado em Angewandte Chemie International Edition , a equipe de pesquisa criou um composto - denominado C7-Pro-Phe - baseado em aminoácidos. Essa molécula isca se assemelha aos ácidos graxos que a E. coli metaboliza. Insira o chamariz em uma célula de E. coli, e será erroneamente reconhecido como um ácido graxo, desencadeando a ativação da enzima P450 inserida. Agora forneça benzeno (C6H6), e as bactérias ficam ocupadas, oxidar C6H6 em C6H6O (fenol). Não há necessidade do kit de laboratório usual - células vivas podem fazer química complexa de forma silenciosa e eficiente.
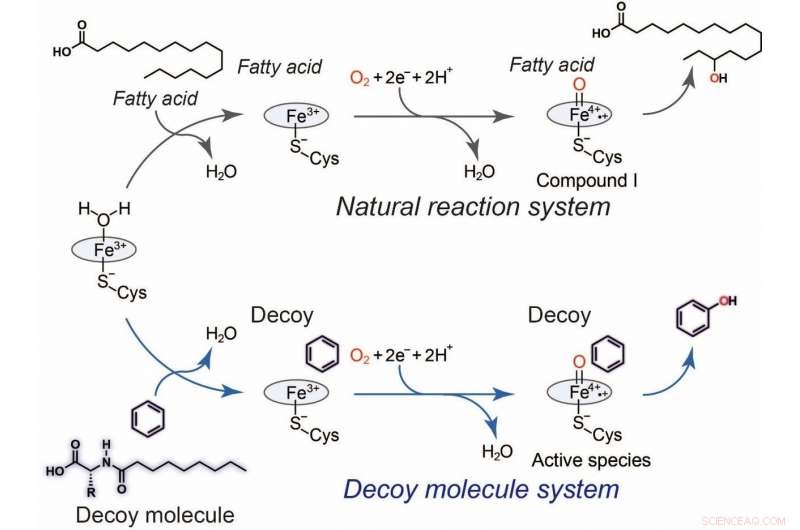
Fig.2 Hidroxilação de benzeno usando moléculas chamariz. Ciclo catalítico geral de P450BM3 (preto) e um ciclo catalítico plausível (azul) para hidroxilação de benzeno catalisada por P450BM3 com auxílio da molécula chamariz. Crédito:Osami Shoji e Masayuki Karasawa
"A vantagem do nosso sistema é que o C7-Pro-Phe pode ser facilmente absorvido pela bactéria, onde ativa P450BM3 na célula. Isso efetivamente transforma cada bactéria em um biocatalisador de célula inteira, "estudo primeiro autor Masayuki Karasawa diz." A célula é um cenário ideal para a reação bioquímica. As iscas realmente remodelam o sítio ativo da enzima, dando-nos controle sobre os aspectos da reação, como estereosseletividade. "
Tudo o que é necessário é um suprimento imediato de glicose - que pode ser reciclada de produtos residuais - para alimentar a E.coli.
Como uma variante da enzima de ocorrência natural - em vez de geneticamente modificada - é expressa pela E. coli, é provável que outras bactérias também possam ser modificadas com o mesmo gene para realizar essa tarefa. Além disso, diferentes iscas podem ser adequados para diferentes substratos ou bactérias. "Um programa combinado de triagem de engodo e mutagênese poderia criar um kit de ferramentas versátil para reações de células inteiras usando bactérias, "diz o co-autor Osami Shoji.