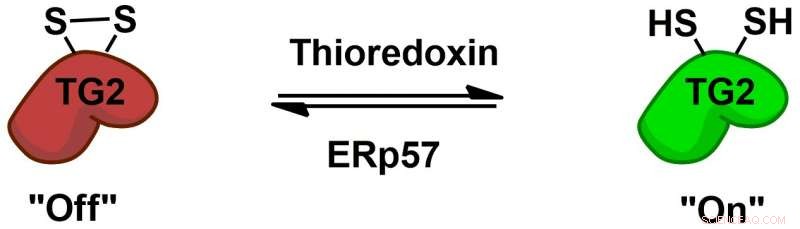
 p A transglutaminase 2 (TG2) é reversivelmente regulada pelos cofatores de proteína tioredoxina e ERp57 por meio de um interruptor redox de dissulfeto alostérico. Crédito:Chaitan Khosla, Universidade de Stanford
p A transglutaminase 2 (TG2) é reversivelmente regulada pelos cofatores de proteína tioredoxina e ERp57 por meio de um interruptor redox de dissulfeto alostérico. Crédito:Chaitan Khosla, Universidade de Stanford
p A doença celíaca é uma doença auto-imune que afeta, segundo algumas estimativas, cerca de 1 em cada 100 pessoas. Os sintomas da doença celíaca são desencadeados pelo glúten, uma proteína encontrada no trigo e plantas relacionadas, mas o glúten não age sozinho para causar os sintomas digestivos que os pacientes sofrem. Em vez, o glúten induz uma resposta imune hiperativa quando é modificado pela enzima transglutaminase 2, ou TG2, no intestino delgado. Nova pesquisa publicada na edição de 23 de fevereiro do
Journal of Biological Chemistry identifica uma enzima que desliga TG2, potencialmente abrindo caminho para novos tratamentos para a doença celíaca. p "Atualmente, faltam terapias para tratar pessoas com doença celíaca. A melhor abordagem agora é apenas uma adesão estrita a uma dieta sem glúten para toda a vida, "disse Michael Yi, um estudante de graduação em engenharia química na Universidade de Stanford que liderou o novo estudo. "Talvez a razão por trás disso seja nosso entendimento relativamente pobre do TG2."
p A bioquímica de como o TG2 interage com o glúten e induz uma resposta imune foi bem estudada, mas mais mistérios básicos permanecem, por exemplo, como o TG2 se comporta em pessoas sem doença celíaca. Chaitan Khosla, o professor em Stanford e diretor de Química de Stanford, Engenharia e Medicina para a Saúde Humana, que supervisionou o novo estudo, conduziu vários estudos mostrando que o TG2 pode ser ativo ou inativo, dependendo da formação ou quebra de uma ligação química específica, chamada de ligação dissulfeto, entre dois aminoácidos na enzima.
p "(E) embora haja uma grande quantidade de proteína transglutaminase 2 no (intestino delgado), está tudo inativo, "Disse Khosla." Quando ficou claro que, embora a proteína fosse abundante, sua atividade era inexistente em um órgão saudável, a questão passou a ser 'O que ativa a proteína, e então o que desliga a proteína? '"Em 2011, A equipe de Khosla identificou a enzima que ativa o TG2 quebrando sua ligação dissulfeto. No novo jornal, os pesquisadores realizaram experimentos em culturas de células e descobriram uma enzima que forma novamente esta ligação, inativando TG2. Esta enzima, ERp57, é conhecido principalmente por ajudar a dobrar as proteínas dentro da célula. Quando desliga o TG2, faz isso fora das células, levantando mais questões sobre suas funções em pessoas saudáveis.
p "Ninguém realmente entende como (Erp57) sai da célula, "Khosla disse." O pensamento geral é que ele é exportado da célula em pequenas quantidades; esta observação particular sugere que ele realmente tem um papel biológico fora da célula. "
p A TG2 é agora também a primeira proteína conhecida por ter um interruptor liga / desliga reversível deste tipo. "Este é um tipo muito diferente de química intermitente do tipo que os químicos medicinais usariam (normalmente), "Khosla disse.
p A compreensão desse mecanismo levou a equipe a investigar se há algum medicamento aprovado pelo FDA que poderia ter como alvo a mudança diretamente. Como estudos anteriores sugeriram que a falta de TG2 não parece afetar negativamente a saúde dos ratos, o bloqueio de TG2 é um caminho promissor para o tratamento de pacientes com doença celíaca sem a necessidade de mudanças ao longo da vida em suas dietas.
