Os químicos do Boston College desenvolveram um novo tecnologia derivada de bactérias para incorporar aminoácidos não canônicos em proteínas de uma ampla classe de organismos, incluindo humanos. Crédito:Biologia Química Celular
As proteínas - as máquinas moleculares que conduzem os processos subjacentes à biologia - são feitas de apenas 20 blocos de construção canônicos chamados aminoácidos. Por quase duas décadas, os cientistas buscaram métodos para criar novos aminoácidos para construir proteínas.
Uma equipe de químicos do Boston College desenvolveu uma tecnologia para incorporar precisamente uma gama de aminoácidos não canônicos úteis em proteínas feitas em eucariotos, a ampla classe de organismos superiores que inclui os humanos, a equipe relatou no jornal Biologia Química Celular .
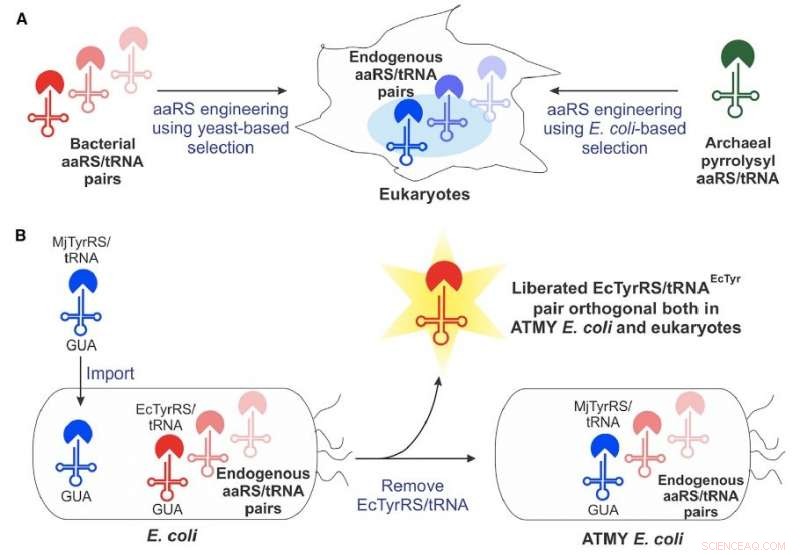
Aproximadamente 15 anos atrás, os cientistas viram pela primeira vez o potencial de uma engenharia, maquinaria genética derivada de bactérias - conhecida como par aminoacil-tRNA sintetase / tRNA - para incorporar aminoácidos não canônicos em proteínas produzidas em células eucarióticas. Mas o método enfrentou uma série de restrições técnicas que limitaram seu amplo desenvolvimento.
A equipe do Boston College superou muitas dessas limitações desenvolvendo uma nova cepa de bactéria E. coli que permite a engenharia fácil do par aminoacil-tRNA sintetase / tRNA derivado da bactéria, de acordo com o professor assistente de química Abhishek Chatterjee, quem liderou o projeto. Esta nova abordagem permitiu a incorporação de vários aminoácidos não canônicos, incluindo p-boronofenilalanina, em proteínas produzidas em células humanas, bem como na cepa de engenharia de E. coli .
Chatterjee disse que a equipe ficou surpresa com a facilidade da nova abordagem, que é descrito no novo relatório "Resurrecting the bacterial tyrosyl-tRNA synthetase / tRNA pair for expansion the genetic code of both E. coli e eucariotos. "
"Criando este romance E. coli cepa necessária a substituição de seu par nativo de aminoacil-tRNA sintetase / tRNA por uma contraparte de um organismo diferente, que prevíamos seria muito difícil, "disse ele." Mas acabou por ser bastante viável. Isso abre essa tecnologia completa. "
Chatterjee disse que a equipe procurou criar um novo método para projetar e monitorar as funções das proteínas como uma forma de expandir a compreensão científica dos processos que orientam as funções das proteínas em nossas células.
"Milhares de proteínas são codificadas no genoma que nos torna quem somos, mas sabemos muito pouco sobre esse processo, "disse Chatterjee." Em células humanas, existem cerca de 20, 000 genes codificadores de proteínas. O que eles estão fazendo e como estão fazendo continua difícil de estudar. Um dos maiores problemas é que se você quiser saber o que eles estão fazendo, você tem que espioná-los. Você precisa anexar uma sonda que possa relatar o que está acontecendo. "
A introdução de tais sondas tem se mostrado difícil, já que o processo freqüentemente danifica a proteína-alvo.
Em qualquer célula, as proteínas são feitas de 20 aminoácidos - um grupo fixo guiado em ordem por instruções genéticas.
"A ideia é que podemos introduzir um novo bloco de construção em proteínas que a natureza não possui - além dos 20 aminoácidos canônicos que a natureza usa, "Chatterjee disse." Se pudermos fazer isso, temos a capacidade de introduzir muito especificamente uma ampla variedade de funcionalidades não naturais em qualquer local de virtualmente qualquer proteína. "
O benefício imediato seria ajudar os pesquisadores que ainda estão desvendando os mistérios da biologia celular e da função das proteínas.
"Você poderia criar uma proteína com um aminoácido não canônico em qualquer local escolhido, carregue-o com sondas que são muito pequenas e emitem um sinal óptico que diz para onde está indo, "Disse Chatterjee." Pode permitir que você manipule o funcionamento da proteína. Você pode introduzir limites, então o que quer que a proteína esteja fazendo, não pode fazer mais nada. E você pode remover a sonda usando um sinal externo, como luz. Esta tecnologia abre inúmeras novas maneiras de começar a sondar e projetar a função da proteína, o que seria muito desafiador de outra forma. "