Os implantes dentários são cada vez mais comuns como substitutos dos dentes na Noruega. A substituição nem sempre vem sem problemas, Contudo. Crédito:Colourbox.com
As moléculas que são mais frequentemente conhecidas por seu potencial de causar câncer podem ter um novo, papel promotor da saúde. Os cientistas estão descobrindo agora como esses "radicais" podem ser usados para prevenir infecções e promover o sucesso de longo prazo dos implantes dentários.
Embora os dentistas recomendem que mantenhamos nossos próprios dentes pelo maior tempo possível, cada vez mais, muitos de nós precisaremos eventualmente de um ou mais dentes substituídos por implantes de titânio. Isso é especialmente verdadeiro para as gerações mais velhas.
Contudo, Os implantes dentários muitas vezes provam ser apenas uma substituição parcialmente bem-sucedida. As bactérias podem colonizar a área ao redor de um implante. As infecções bacterianas ao redor de um implante podem levar à perda do osso que suporta o implante, deixando o paciente com grande necessidade de tratamento extensivo e, como resultado, saúde bucal geral precária.
Se o osso ao redor de um implante infeccionar, existe um sério risco de que o paciente precise de tratamento e manutenção dentária restauradora abrangente, a fim de manter a função do implante e restaurar o osso perdido, se possível. Consequentemente, a pesquisa em biomateriais que podem ser usados para aumentar e orientar a regeneração de osso perdido se tornou uma área importante da pesquisa odontológica.
Biofilmes em implantes
Para que um implante dentário funcione, ele deve ser preso firmemente ao osso maxilar. Isso significa que as células ósseas precisam vencer as bactérias na chamada "corrida pela superfície" do implante. Ao vencer a corrida, as células ósseas formarão novo tecido ósseo ao redor do implante, anexar o implante ao osso.
Contudo, muitas vezes são as bactérias que vencem a corrida. Eles formam um biofilme, uma fina camada de bactérias na superfície do implante. - Biofilme é uma forma inteligente de as bactérias colonizarem superfícies; torna as bactérias mais fortes, explica David Wiedmer, bolsista de pesquisa na Faculdade de Odontologia da Universidade de Oslo. Se a bactéria dominar a superfície do implante, o implante é propenso a infecções, com consequências potencialmente graves para a saúde do paciente.
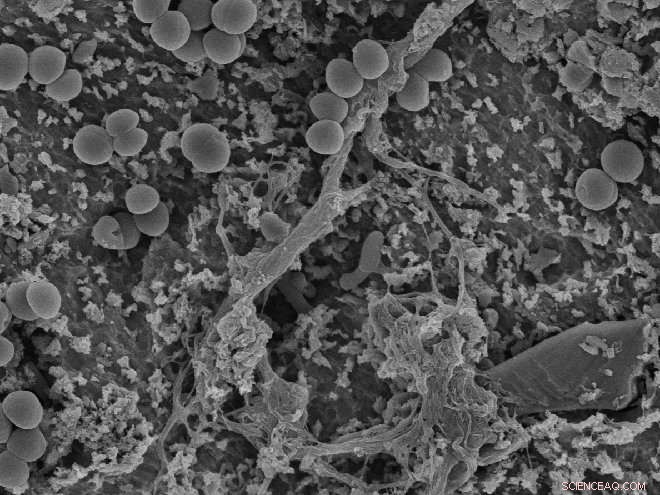
As bactérias venceram a corrida para conquistar a superfície:os «pontos» circulares são bactérias que se fixaram na superfície de um implante. Os testes de Wiedmer mostraram que as moléculas radicais podem contribuir para desorganizar as bactérias e causar um efeito antibacteriano. Crédito:OD, UiO / David Wiedmer
Os implantes infectados geralmente são tratados com antibióticos. - Quando as bactérias formam um biofilme, antibióticos muitas vezes não funcionam porque as bactérias são protegidas por um biofilme. À luz do aumento dramático de bactérias resistentes a antibióticos, há uma necessidade urgente de encontrar tratamentos alternativos, diz Wiedmer, que é originalmente um engenheiro mecânico. Ele começou a olhar para os radicais livres como alternativa. Essas moléculas instáveis podem causar estresse nas bactérias, que por sua vez pode criar um efeito antibacteriano.
Moléculas de radicais altamente reativas
Os radicais livres são moléculas instáveis porque têm um elétron desemparelhado. Assim, eles estão sempre procurando por outro elétron para emparelhar. Os radicais livres são conhecidos por serem moléculas nocivas e patogênicas que podem causar alterações no DNA, o que, por sua vez, pode criar mutações que podem levar ao câncer. A hipótese de Wiedmer era que a reatividade dos radicais livres também poderia ser usada para matar bactérias.
Ele baseou sua ideia em um processo químico conhecido, fotocatálise:Quando o dióxido de titânio (TiO2) é exposto à luz ultravioleta, como encontrado na luz do sol, na presença de oxigênio, a superfície se limpa de qualquer sujeira orgânica, quebrando-o em água e oxigênio. Esse processo de limpeza é baseado na formação de radicais livres e é a mesma reação que se usa nas células solares para produzir energia.
Os implantes dentários também possuem TiO2 em sua superfície. Quase todos os implantes dentários são feitos de titânio, e TiO2 é criado quando o titânio entra em contato com o oxigênio do ar ou sangue, por exemplo. quando um implante é inserido na boca.
Catálise escura para tratamento e prevenção
Contudo, é difícil produzir reações fotocatalíticas nos implantes. Isso ocorre devido ao problema óbvio de adicionar a luz solar necessária à reação entre o TiO2 na superfície do implante e o oxigênio no sangue quando o implante já está inserido no osso da mandíbula.

Ao investigar a rapidez com que a solução química perdeu sua cor azul, O candidato a Ph.D. David Wiedmer pôde detectar quais tipos de dióxido de titânio (TiO2) contribuíram para que as bactérias não estabelecessem biofilme nos implantes. Crédito:OD, UiO / Margit Selsjord
Por esta razão, Wiedmer estudou o tratamento de infecções bacterianas em implantes usando um método que ele chama de "catálise escura". Ao combinar TiO e peróxido de hidrogênio (H2O2), em vez de água e luz do sol, ele consegue um efeito semelhante à fotocatálise. Quando H2O2 é adicionado a um implante coberto por uma camada de TiO2, radicais livres também são liberados - mas desta vez no escuro.
Dadas as fortes propriedades antibacterianas dos radicais livres produzidos, Wiedmer investigou a catálise escura no TiO2 em duas aplicações biomédicas diferentes. O primeiro aplicativo testado foi para tratar uma infecção existente em torno de um implante. Sua pesquisa também examinou se o método poderia ter um efeito preventivo em "andaimes", estruturas porosas que podem ser inseridas no osso maxilar para apoiar e guiar as células ósseas para crescer e formar um "novo" osso.
Promissor, mas difícil de implementar
Wiedmer tem motivos para estar otimista de que um dia será possível controlar as infecções bacterianas ao redor dos implantes dentários e evitá-las com mais facilidade. Seus estudos mostraram que a catálise escura é um método promissor para tratar infecções, pois cria radicais que ajudam a combater as bactérias.
A pesquisa também indicou que a catálise escura poderia ser mais desenvolvida e aplicada a estruturas ósseas. Esses andaimes suportam a regeneração do tecido ósseo perdido no qual os implantes podem ser inseridos. Em seus estudos, Wiedmer descobriu que os radicais formados por catálise escura podem impedir que as bactérias colonizem a superfície de estruturas porosas de TiO2.
"O efeito preventivo é realmente mais importante do que seu uso no tratamento de infecções pré-existentes. Afinal, implantes que causam problemas devido a infecções podem, como último recurso, ser extraído. Mas você não pode remover facilmente um andaime poroso, uma vez que o osso já cresceu nos poros do andaime, " ele explica.
Contudo, há muito mais pesquisas a serem feitas antes que a catálise escura possa ser aplicada em cirurgias odontológicas. Wiedmer não pôde descartar de forma conclusiva a possibilidade de que os radicais também danifiquem o DNA celular enquanto lutam contra as bactérias. - Espero que esta nova estratégia de usar radicais livres para matar bactérias possa nos ajudar a encontrar tratamentos alternativos aos antibióticos. Embora ainda haja um caminho a percorrer, incluindo ensaios clínicos, este projeto pode eventualmente lançar um pouco mais de luz no escuro, Wiedmer diz com um sorriso.