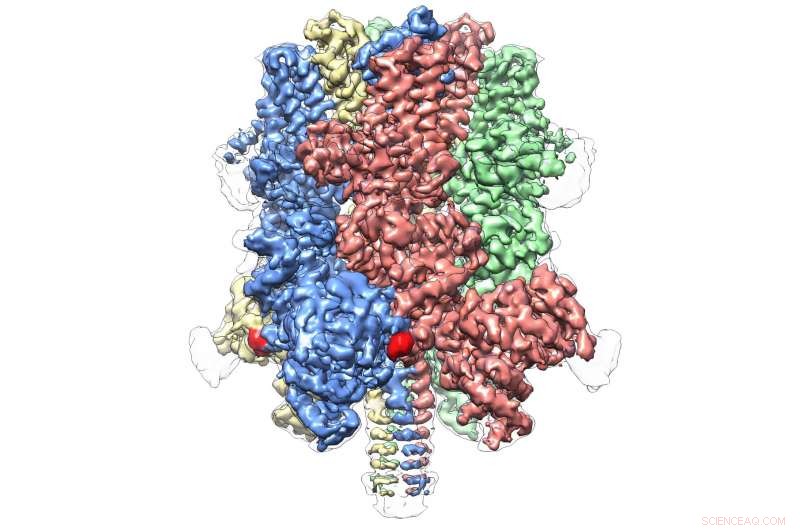
O TRPM4 humano ligou-se ao agonista Ca + e ao modulador DVT a 3,8 Å. Crédito:Wei Lü, Ph.D.
Uma equipe liderada por cientistas do Van Andel Research Institute (VARI) revelou pela primeira vez a estrutura de nível atômico de um alvo promissor de drogas para doenças como acidente vascular cerebral e lesão cerebral traumática.
Chamado TRPM4, esta proteína é encontrada em tecidos por todo o corpo, incluindo o cérebro, coração, rim, cólon e intestinos, onde desempenha um papel importante na regulação do fluxo sanguíneo através da constrição dos vasos sanguíneos, bem como definir o ritmo do coração e moderar as respostas imunológicas.
"Compreender o papel que o TRPM4 desempenha na regulação da circulação é vital, mas por anos a pesquisa foi limitada pela falta de conhecimento sobre sua arquitetura molecular, "disse Wei Lü, Ph.D., professor assistente da VARI e autor principal em um estudo que descreve a estrutura do TRPM4, publicado hoje em Natureza . "Nossas descobertas não fornecem apenas informações detalhadas, mapa de nível atômico desta proteína crítica, mas também revelam facetas completamente inesperadas de sua composição. "
TRPM4 está criticamente envolvido na regulação do suprimento de sangue ao cérebro, que compreende apenas cerca de 2 por cento do peso total do corpo, mas recebe de 15 a 20 por cento de seu suprimento de sangue. Condições que interrompem o fluxo sanguíneo no cérebro, como derrame, traumatismo crâniano, edema cerebral e hipertensão, podem ter consequências devastadoras e são problemas significativos de saúde pública.
"Existem muitas salvaguardas no sistema circulatório do cérebro para proteger contra uma interrupção repentina no fornecimento de sangue, um dos quais é TRPM4, "Esperamos que uma melhor compreensão da aparência dessa proteína dê aos cientistas um projeto molecular no qual basear o projeto de medicamentos mais eficazes com menos efeitos colaterais", disse Lü.
A estrutura do TRPM4 é marcadamente diferente das outras moléculas da superfamília TRP, uma categoria de proteínas que medeiam as respostas às sensações e estímulos sensoriais, como dor, pressão, visão, temperatura e sabor. Amplamente conhecido como canais iônicos, proteínas como TRP aninham-se nas membranas das células, atuando como guardiões dos sinais químicos que entram e saem da célula.
Mesmo dentro de sua própria subfamília, que compreende oito moléculas no total, TRPM4 parece ser totalmente único. A publicação de hoje representa a primeira visão atômica de um membro da subfamília TRPM.
Ele revela uma estrutura em forma de coroa, com os quatro picos compondo um grande domínio N-terminal - uma marca registrada das proteínas TRPM. Esta região, encontrado no início da molécula, é um importante local de interação com o ambiente celular e outras moléculas do corpo. Na extremidade oposta do TRPM4, comumente chamado de domínio C-terminal, A equipe de Lü encontrou uma estrutura semelhante a um guarda-chuva apoiada por um "poste" e quatro "nervuras" helicoidais - características nunca antes observadas.
As descobertas foram possíveis graças à suíte de microscopia crioeletrônica avançada David Van Andel da VARI, que permite aos cientistas ver alguns dos menores componentes da vida em detalhes requintados. O maior microscópio da VARI, o titã Krios, é um dos menos de 120 no mundo e é tão poderoso que pode visualizar moléculas 1/10, 000º da largura de um cabelo humano.
A estrutura de Lü é a segunda estrutura molecular determinada no Krios do Instituto desde a conclusão da instalação da suíte no início deste ano.