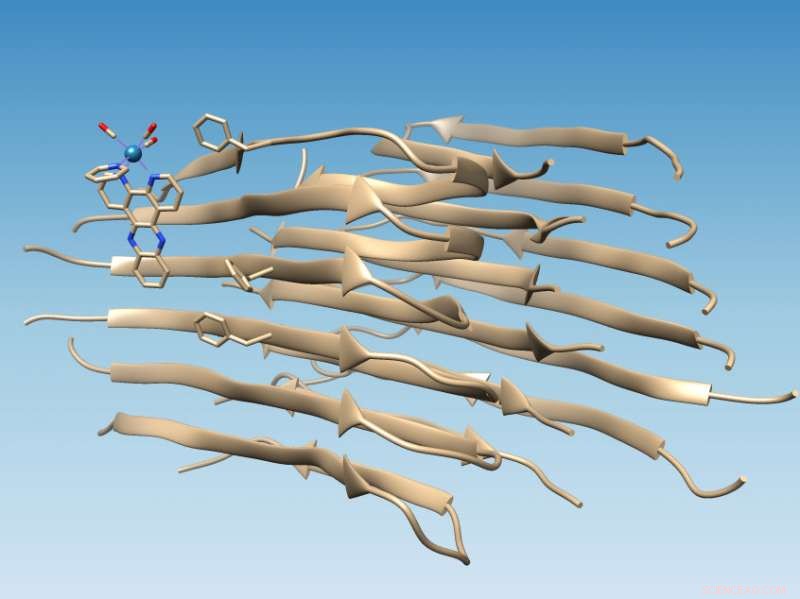
Um complexo à base de rênio desenvolvido na Rice University se liga a fibrilas de peptídeo beta amilóide mal dobrado, que marca a localização de uma fenda hidrofóbica que poderia servir como alvo de drogas, e oxida a fibrila, o que muda sua química de uma forma que pode impedir uma maior agregação. Crédito:Martí Group / Rice University
Uma sonda inventada na Rice University que se acende quando se liga a um peptídeo beta amilóide mal dobrado - o tipo suspeito de causar a doença de Alzheimer - identificou um local de ligação específico na proteína que poderia facilitar melhores medicamentos para tratar a doença.
Melhor ainda, o laboratório descobriu que quando a sonda metálica é iluminada, catalisa a oxidação da proteína de uma forma que eles acreditam poder impedir que ela se agregue no cérebro dos pacientes.
O estudo feito em longas fibrilas amilóides apoia simulações de computador por colegas da Universidade de Miami que previram que o complexo de metal fotoluminescente se ligaria ao peptídeo amilóide próximo a uma fenda hidrofóbica (para evitar água) que aparece na superfície do agregado de fibrilas. Essa fenda representa um novo alvo para as drogas.
Encontrar o local foi relativamente simples, uma vez que o laboratório do químico da Rice, Angel Martí, usou seus complexos à base de rênio para direcionar as fibrilas. O complexo de troca de luz brilha quando atingido por luz ultravioleta, mas quando se liga à fibrila, torna-se mais de 100 vezes mais brilhante e causa a oxidação do peptídeo amilóide.
"É como caminhar na praia, - disse Marti. - Você pode ver que alguém esteve lá antes de você olhando as pegadas na areia. Embora não possamos ver o complexo de rênio, podemos encontrar a oxidação (pegada) que ela produz no peptídeo amilóide.
"Essa oxidação só acontece bem próximo ao local onde se liga, ", disse ele." A real importância desta pesquisa é que nos permite ver com um alto grau de certeza onde as moléculas podem interagir com fibrilas beta-amilóides. "
O estudo aparece na revista Chem .
"Acreditamos que esta fenda hidrofóbica seja um sítio de ligação geral (na beta amilóide) para moléculas, "Martí disse." Isso é importante porque a agregação de beta amilóide foi associada ao início da doença de Alzheimer. Sabemos que a beta amiloide insolúvel fibrilar é tóxica para as culturas de células. Os oligômeros amiloides solúveis que são feitos de várias unidades mal dobradas de beta amiloide também são tóxicos para as células, provavelmente até mais do que fibrilar.
"Há um interesse em encontrar medicamentos que eliminem os efeitos deletérios dos agregados de beta amilóide, "disse ele." Mas para criar drogas para estes, primeiro precisamos saber como as drogas ou moléculas em geral podem se ligar e interagir com essas fibrilas, e isso não era muito conhecido. Agora temos uma ideia melhor do que a molécula precisa para interagir com essas fibrilas. "

Uma sonda metálica acende quando se liga a um peptídeo beta amilóide mal dobrado em um experimento na Rice University. A sonda identificou um sítio de ligação que poderia facilitar melhores drogas para tratar a doença de Alzheimer. Crédito:Brandon Martin / Rice University
Quando os peptídeos amilóides se dobram adequadamente, eles escondem seus resíduos hidrofóbicos enquanto expõem seus resíduos hidrofílicos (que atraem água) à água. Isso torna as proteínas solúveis, Disse Martí. Mas quando o beta amilóide se desdobra, deixa dois resíduos hidrofóbicos, conhecido como Valina 18 e Fenilalanina 20, exposto para criar a fenda hidrofóbica.
"É perfeito, porque então as moléculas com domínios hidrofóbicos são levadas a se ligar lá, "Martí disse." Eles são compatíveis com esta fenda hidrofóbica e se associam com a fibrila, formando uma forte interação. "
Se a oxidação resultante impedir que as fibrilas se agregem ainda mais na substância pegajosa encontrada nos cérebros de pacientes com Alzheimer, pode ser o início de uma estratégia útil para interromper a agregação antes que os sintomas da doença apareçam.
“É um sistema muito atraente porque usa luz, que é um recurso barato, "Martí disse." Se pudermos modificar os complexos para que absorvam a luz vermelha, que é transparente ao tecido, podemos ser capazes de realizar essas modificações fotoquímicas em animais vivos, e talvez algum dia em humanos. "

Da esquerda, Christopher Pennington, cientista pesquisador da Rice University, estudante de graduação Bo Jiang e Angel Martí, professor associado de química e bioengenharia, executar um experimento beta amilóide no laboratório Martí. Crédito:Brandon Martin / Rice University
Ele disse que a ativação de luz permite que os pesquisadores tenham um "controle primoroso" da oxidação.
"Imaginamos que algum dia seja possível prevenir os sintomas de Alzheimer, visando a beta amiloide da mesma forma que tratamos o colesterol em pessoas agora para prevenir doenças cardiovasculares, "Martí disse." Isso seria maravilhoso. "