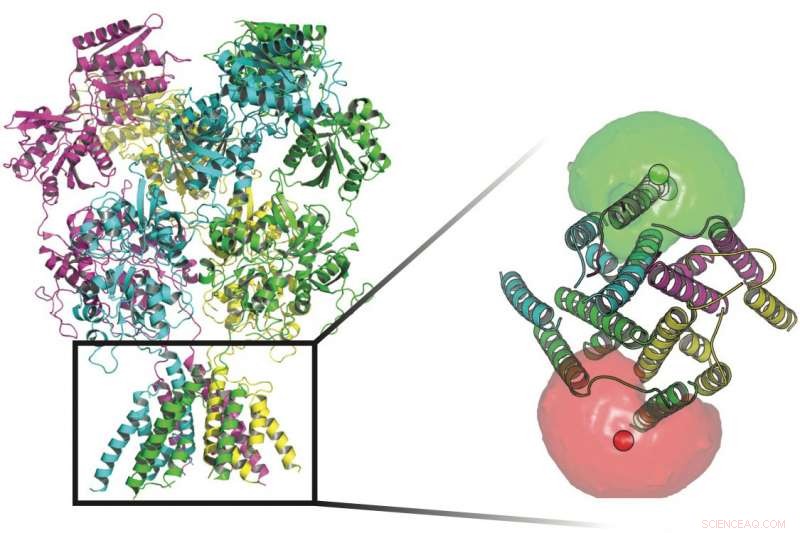
Cientistas da Rice University e da UTHealth rastrearam as conformações de proteínas que ficam de guarda nos canais transmembrana nas paredes das células nervosas. Na base das proteínas desta imagem estão os fluoróforos (esferas vermelhas e verdes) rodeados por nuvens de fluoróforos que ajudaram os pesquisadores a definir os movimentos do portão que permite que os íons fluam através da membrana. Crédito:Rice University / UTHealth
A capacidade de rastrear os movimentos de moléculas individuais revelou como as proteínas na superfície das células nervosas controlam os portões que transformam os sinais químicos em sinais elétricos. A descoberta é um passo adiante no detalhamento dos mecanismos envolvidos na doença neurológica, de acordo com pesquisadores da Rice University e do University of Texas Health Science Center em Houston (UTHealth).
Usando imagens sofisticadas e métodos estatísticos, os cientistas empregaram técnicas de imagem FRET de molécula única para estabelecer uma cabeça de ponte no portão do receptor NMDA que, quando ativado, permite que os íons fluam através da membrana da célula nervosa.
FRET significa transferência de energia de ressonância de Förster. É uma forma de usar a luz emitida por duas moléculas marcadas com fluorescentes como uma régua sensível para distâncias muito pequenas, como a abertura no canal do receptor NMDA.
A química de arroz Christy Landes, um especialista em FRET de uma única molécula, e Vasanthi Jayaraman, professor de bioquímica e biologia molecular na McGovern Medical School da UTHealth, cuja especialidade é a bioquímica do receptor NMDA, se uniram para reunir a primeira evidência experimental detalhando a dinâmica de como os receptores alteram suas formas para controlar a sensibilidade do portão aos sinais químicos. O novo estudo aparece em Nature Chemical Biology .
O receptor NMDA é um conjunto de quatro subunidades de proteína, cada um com quatro domínios, e cada um desses domínios tem uma função particular. Coletivamente, eles abrangem a membrana celular. Cada subunidade pode ter muitos "estados, "ou formas, que regulam quais sinais elétricos - e quantos deles - passam. As subunidades ficam em cada lado do canal e são ativadas quando se ligam aos ligantes do neurotransmissor glutamato e glicina e acionam a via de sinalização que permite que íons carregados positivamente passem para a célula.
"Esses receptores são essenciais para a função fisiológica normal, "Jayaraman disse." Muitas vezes você pode não querer ligar ou desligar a sinalização. Você pode querer marcar a extensão da sinalização. Uma vez que entendemos todos os estados da proteína, podemos começar a pensar em maneiras de fazer isso, mantendo assim a proteína ativa, mas em vários graus, conforme necessário.
"É importante para o desenvolvimento de drogas entender essas dinâmicas porque os movimentos e as propriedades energéticas dessas proteínas ditam suas funções específicas, "ela disse." Nós fomos capazes de fazer as duas coisas. "
Esse conhecimento pode levar a drogas multifuncionais que influenciam os canais de maneiras sutis, Landes disse. Antagonistas do receptor NMDA conhecidos incluem anestésicos comuns, opioides sintéticos como metadona e drogas dissociativas como cetamina e óxido nitroso. Suspeita-se da função deprimida do receptor NMDA em déficits de memória comumente associados ao envelhecimento. O álcool é conhecido por inibir o glutamato, um dos dois neurotransmissores que se ligam ao NMDA.

As quatro subunidades das proteínas do receptor NMDA podem ter, cada uma, vários estados que regulam quais sinais elétricos passam pela membrana de uma célula nervosa. As subunidades são ativadas quando se ligam aos ligantes do neurotransmissor glutamato e glicina e acionam a via de sinalização que permite que íons carregados positivamente passem para a célula. Crédito:Rice University / UTHealth
"Muitos projetos de medicamentos têm como princípio básico que há uma maneira de vincular, e você basicamente liga ou desliga algo, "Landes disse." Mas é óbvio que este tipo de proteína receptora não é apenas ativado ou desativado. Existem várias interações conformacionais que melhoram ou degradam a sinalização. "
Em um estudo anterior, a equipe analisou as conformações de um sistema menor e mais simples, mas relacionado, o domínio de ligação do agonista tipo C-clamp de outro receptor, AMPA. O AMPA medeia a transmissão rápida do sinal no sistema nervoso central. A técnica FRET de molécula única permitiu aos pesquisadores obter os primeiros instantâneos das várias conformações de grampo da proteína AMPA em repouso e também quando ligada a uma gama de moléculas-alvo medindo a distância entre duas marcas moleculares ativadas por luz.
Desta vez, os pesquisadores procuraram entender a abertura do canal em si - como as proteínas que compõem o canal do receptor NMDA se movem para ativar o portão iônico. Ao adicionar marcas fluorescentes em todo o canal e amostrá-las ao longo do tempo, eles foram capazes de mapear a paisagem energética do segmento transmembrana da proteína em seu estado de repouso ou sob a influência de ligantes que modulam o portão entre aberto, fechado e intermediário. O estado estrutural de cada canal influencia diretamente os sinais elétricos que podem passar.
Eles descobriram que o estado livre de agonista (repouso) é estruturalmente rígido, o que confirmou sua resistência energética em adotar conformações que permitissem a abertura do canal. Agonistas como o glutamato são os produtos químicos-alvo que acionam o transporte de sinais elétricos através do canal. Os pesquisadores confirmaram que, na presença do agonista primário, o canal NMDA era menos rígido e, portanto, capaz de fazer a transição mais facilmente entre as possíveis conformações de canal aberto.
O trabalho também mostrou como dois moduladores conhecidos por interagir com diferentes partes do receptor completo afetam a conformação e a rigidez do canal. Íons de zinco, apesar da ligação à porção extracelular do receptor longe do canal, induzir um canal rígido com barreiras energéticas significativas para a abertura, semelhante ao estado de repouso do receptor. Em contraste, descobriu-se que o dizocilpina "bloqueador de poros" aumenta a energética das transições entre múltiplas conformações que não se relacionam com a abertura do canal.
Landes disse que, em vez de capturar estados estáticos, como normalmente é feito com raios-X, "Estávamos observando as mudanças de distância em todo o canal de maneira dinâmica. É muito mais complicado." Isso deu a eles um conjunto de dados mais parecido com um filme do que um instantâneo, ela disse.
Ela disse que o estudo requer novas técnicas para purificar e estabilizar as proteínas completas, que foram retirados dos neurônios de roedores. "Havia três peças-chave para este projeto:lidar com as proteínas completas, purificá-los e rotulá-los no nível de receptor único e realizar a análise de dados para descobrir o que isso significa.
"Essa é realmente a base aqui, "ela disse." Agora podemos fazer essas medições para sistemas muito mais complicados. "