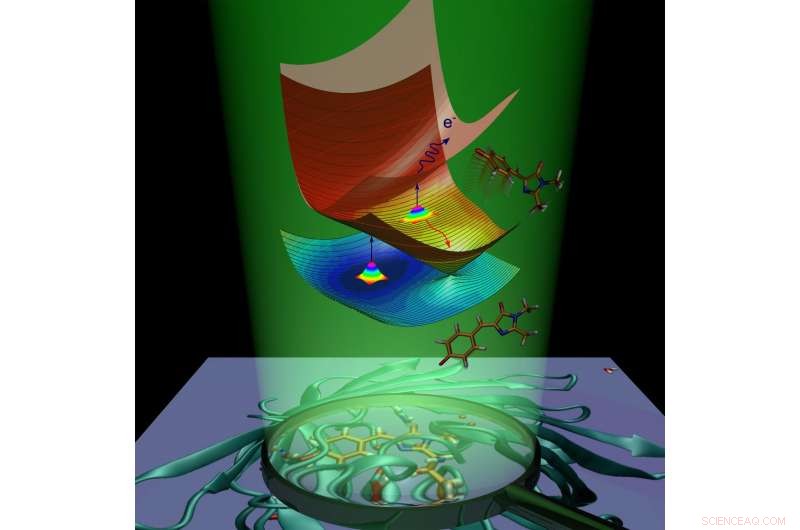
Dinâmica molecular do cromóforo da proteína fluorescente verde causada pela absorção da luz. Crédito:Anastasia Bochenkova
Pesquisadores da Lomonosov Moscow State University, em cooperação com físicos moleculares dinamarqueses, revelaram o mecanismo que determina a sensibilidade da proteína fluorescente verde à exposição à luz. Os cientistas provaram que um grupo cromóforo isolado é capaz de emitir luz fora do ambiente proteico, enquanto a função da proteína é aumentar suas propriedades fluorescentes. Os resultados são publicados no Jornal da American Chemical Society .
As proteínas da família GFP são amplamente utilizadas como biomarcadores. Com a ajuda deles, os pesquisadores podiam visualizar os processos biológicos ocorrendo dentro das células vivas. Essas proteínas são amplamente utilizadas em biologia molecular e celular devido à sua capacidade única de fluorescência após a absorção de luz de um determinado comprimento de onda.
Grupos de cromóforos, ou cromóforos, são responsáveis pela absorção de luz. O cromóforo é composto por apenas três resíduos de aminoácidos. Até agora, os pesquisadores acreditavam que o ambiente proteico fazia com que seu cromóforo emitisse luz sob irradiação. Essa ideia foi apoiada pelo fato de que o cromóforo isolado perde suas propriedades fluorescentes com a desnaturação da proteína, isto é, desdobramento da proteína. Pela primeira vez, os autores previram e provaram experimentalmente que o cromóforo isolado também pode apresentar fluorescência fora do ambiente proteico, mas apenas em certas temperaturas.
Após a absorção de luz, a proteína fluorescente ganha energia extra e passa por uma transição para o estado eletronicamente excitado. A molécula de proteína está se esforçando para retornar ao estado fundamental, livrando-se do excesso de energia. Esse processo é chamado de desativação e ocorre de duas maneiras. O primeiro é a fluorescência. Em trânsito do estado animado para o estado fundamental, o cromóforo emite energia na forma de luz, e como resultado, a proteína fica luminosa.
A segunda maneira é chamada de relaxamento não radiativo. Durante este processo, energia de excitação eletrônica, transferido para uma molécula após a absorção de luz, é transformada em energia vibracional de núcleos. A conversão interna dentro da proteína fluorescente verde é seguida por uma reação química - isomerização cis-trans do cromóforo (ou seja, rotação intramolecular em torno de uma das ligações duplas dentro da molécula).
No caso do cromóforo aniônico (carregado negativamente) da proteína fluorescente verde, a energia também pode ser transferida para um elétron, que sai do cromóforo. O cromóforo, que sofre isomerização ou perde um elétron, remove o excesso de energia eletrônica e não fica fluorescente. A fluorescência é chamada de canal radiativo de desativação, enquanto a conversão interna e a emissão de elétrons são chamadas de canais não radiativos. Os cientistas usaram experimentalmente os dois canais não radiativos para estudar o decaimento do estado excitado e a recuperação do estado fundamental do cromóforo GFP isolado em várias temperaturas.
Os cientistas mostraram que o cromóforo GFP isolado pode ficar preso no estado excitado devido à presença de barreiras de energia intrínsecas ao longo das vias de desativação não radiativa. Quando o cromóforo é resfriado a 100 K, o trapping dura nanossegundos, habilitando assim o canal radiativo lento. As barreiras de captura evitam que o cromóforo retorne ao estado fundamental por meio de uma conversão não radiativa rápida e fazendo com que a molécula fique fluorescente.
A química Anastasia Bochenkova da Lomonosov Moscow State University diz:"O cromóforo GFP é intrinsecamente fluorescente. As interações entre o grupo cromóforo e o ambiente de proteína mais próximo melhoram as condições para aprisionar o cromóforo no estado excitado, aumentando assim a fluorescência molecular. Como resultado, o canal radiativo torna-se predominante dentro da proteína já em temperatura ambiente. "
Os cientistas estudaram as propriedades dos cromóforos teoricamente e experimentalmente. Os cientistas elaboraram um modelo teórico e estimaram o tempo de vida em estado de excitação do cromóforo isolado, com base nos cálculos da química quântica de alto nível. Esses cálculos requerem recursos de computação de alto desempenho, e os cientistas usaram o Centro de Supercomputação Lomonosov para seus estudos.
Os cientistas dinamarqueses projetaram e criaram uma nova técnica experimental para estudar a dinâmica molecular induzida pela luz de cromóforos carregados isolados in vacuo - espectroscopia de ação de bomba-sonda de femtossegundo com resolução temporal 2-D. Ambos os tempos de atraso entre dois pulsos de laser de femtossegundos e o tempo de decaimento de uma ação molecular particular foram variados. A nova técnica resolve a dinâmica induzida pela luz do cromóforo GFP à medida que acontece em diferentes canais de decaimento através dos estados eletrônico excitado e de solo, dependendo da temperatura. Com base nos resultados, os pesquisadores concluíram que os cromóforos GFP nativos são intrinsecamente capazes de apresentar fluorescência fora do ambiente proteico com um tempo de vida de nanossegundos, apoiando totalmente as previsões teóricas.
Anastasia Bochenkova diz, "Nossa pesquisa visa revelar mecanismos moleculares de funcionamento de sistemas vivos. Um desafio fundamental é entender a relação entre as propriedades de um biossistema sensível à luz inteiro e seu cromóforo ativo muito menor, que está no cerne da maquinaria molecular. Aqui, mostramos que as propriedades de um único cromóforo são importantes para a compreensão dos mecanismos de ação de toda a proteína GFP. Este conhecimento está na interseção da física, química e biologia, e resulta na revisão do paradigma prevalecente sobre o papel do ambiente proteico na fluorescência da proteína GFP. Além de resolver a questão sobre a origem da fluorescência intrínseca da GFP, o trabalho mostra que o conhecimento molecular detalhado obtido por meio de cálculos de química quântica de alto nível pode ser usado em conjunto com a engenharia molecular na concepção de novos biomateriais funcionais com fotorresposta ideal. "