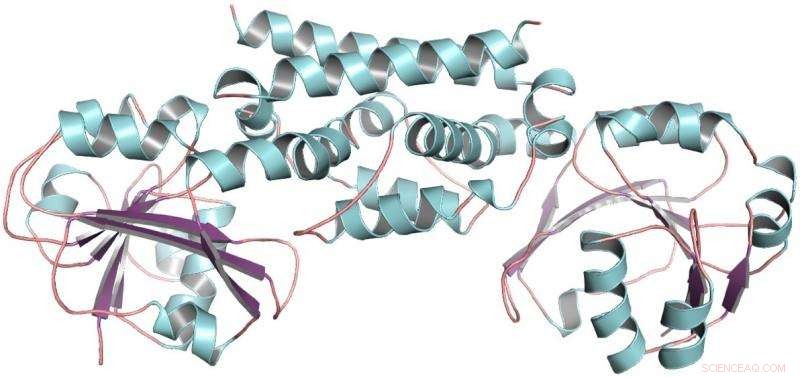
A estrutura tridimensional da enzima PDH da soja, uma leguminosa. Essa estrutura ajudou a mostrar que apenas uma mutação permitiu que as leguminosas desenvolvessem uma nova forma de produzir o aminoácido tirosina. Crédito:Craig Schenck
Enquanto você morde seu próximo sanduíche de pasta de amendoim e geléia, mastigue isso:o amendoim que você está comendo tem um segredo.
É sutil. O amendoim e seus parentes - leguminosas - não têm um, mas duas maneiras de fazer o aminoácido tirosina, um dos 20 necessários para fazer todas as suas proteínas, e um nutriente humano essencial. Isso pode parecer pequeno, mas por que essa família de plantas tem uma maneira única de fazer um bloco de construção químico tão importante é um mistério que remonta à década de 1960 e chamou a atenção de Hiroshi Maeda, um professor de botânica na Universidade de Wisconsin – Madison.
"Estamos interessados em química vegetal, tentando entender como as plantas produzem tantos compostos químicos diferentes, muitos dos quais são importantes para a nossa sociedade humana como alimento, fibra, alimentação, combustível, medicina - tantas coisas, "diz Maeda.
Essas moléculas importantes começam a partir de compostos mais simples, como a tirosina, que é o precursor da morfina e de inúmeros outros produtos químicos interessantes e úteis.
Em uma nova pesquisa publicada na edição de 26 de junho da Nature Chemical Biology , Maeda e seu aluno Craig Schenck, junto com colaboradores da Washington University em St. Louis, relatam como a família das leguminosas desenvolveu sua segunda via de tirosina. Eles descobriram a estrutura de uma nova enzima vegetal, um que poderia ser uma ferramenta útil para biotecnologistas tentando controlar a produção de tirosina e seus derivados. E eles ligaram uma grande mudança evolutiva no metabolismo das plantas a uma única mutação na nova enzima.
Nas décadas de 1960 e 70, cientistas pesquisaram o mundo das plantas para descobrir como eles fabricam os principais compostos metabólicos, como aminoácidos. Embora todas as plantas usem um caminho, conhecido como ADH, para fazer tirosina, a família das leguminosas - ervilhas, feijões, amendoim - adicionado exclusivamente um segundo, chamado PDH, que de outra forma era encontrada apenas em micróbios. Ninguem sabia porque, e o problema foi deixado de lado.
Mas dois anos atrás, Maeda e Schenck tiraram o pó do velho mistério. Cavando, eles descobriram os genes responsáveis pela produção da tirosina. Eles descobriram que as leguminosas desenvolveram suas enzimas PDH a partir de outras ADH existentes, pouco antes de amendoins e ervilhas evoluírem para linhagens separadas. As enzimas irmãs eram muito semelhantes, o que significava que apenas um pequeno número de mudanças poderia explicar como as enzimas ADH evoluíram para as PDH. Mas ainda havia muitas mudanças para testar uma por uma para ver quais tiveram um efeito.
Então Maeda recebeu uma ligação de Joe Jez, um bioquímico na Universidade de Washington. Com a aluna de Jez Cynthia Holland, as duas equipes colaboraram para purificar a enzima PDH da soja, uma leguminosa, e determinar sua estrutura tridimensional. Com a estrutura do PDH em mãos, Schenck pôde ver que ao longo do tempo evolutivo, apenas algumas mutações ocorreram no local onde ocorrem as reações químicas. Em vez de dezenas de mutações para tentar, ele tinha apenas dois.
Schenck descobriu que, ao alterar um único aminoácido no centro da enzima, ele foi capaz de converter amplamente a enzima PDH da soja em sua enzima ancestral ADH. A mudança funcionou para enzimas de várias espécies, e funcionou ao contrário:Schenck poderia fornecer enzimas ADH de plantas não leguminosas com características semelhantes ao PDH.
Maeda e Schenck descobriram que os legumes desenvolveram uma nova maneira de fazer um importante produto químico, principalmente por tropeçar em um único, switch crucial.
"O resultado mais surpreendente é que um único resíduo realmente desempenhou um papel importante na mudança para fazer esta enzima específica da leguminosa, "diz Maeda." E isso levanta uma questão interessante de por que outros grupos de plantas nunca desenvolveram esta enzima única. Porque apenas com chance aleatória, talvez essa mutação tenha ocorrido, mas nunca foi mantida. "
Por que as leguminosas mantiveram seu novo caminho de tirosina, e que vantagem pode oferecer, exigirá mais trabalho.
Outra lição, diz Maeda, é que a mesma chave que transforma as enzimas do ADH em PDH bloqueia a capacidade da tirosina de inibir a função da enzima. Embora esse tipo de autorregulação seja normalmente útil para as células, Maeda acha que a insensibilidade do PDH à tirosina pode ser uma benção para ajudar a produzir mais tirosina, e seus derivados úteis, em sistemas como fermento ou plantas modificadas.
"O pensamento é que papoula do ópio, por exemplo, está produzindo tirosina por meio de uma via padrão do ADH que é provavelmente inibida pela tirosina, "explica Schenck, que recentemente completou seu doutorado no laboratório de Maeda, discutindo possíveis aplicações para a nova pesquisa. "Se pudermos introduzir uma enzima que não seja inibida pela tirosina, talvez possamos aumentar o pool total do precursor da tirosina para aumentar a produção de morfina. Pode ser uma ferramenta útil em outras espécies de plantas ou mesmo em micróbios. "