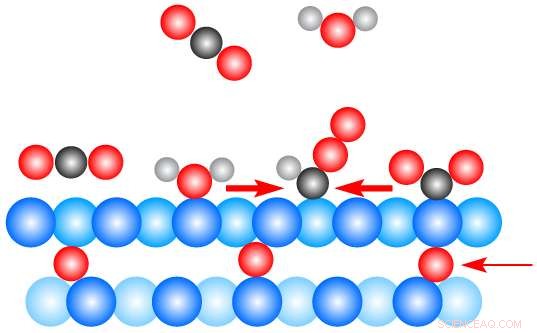
Nesta ilustração em escala atômica, traços de oxigênio (vermelho) logo abaixo de uma superfície de cobre (azul), desempenham um papel fundamental na condução de uma reação catalítica na qual dióxido de carbono (moléculas pretas e vermelhas) e água (moléculas vermelhas e brancas) interagem nos estágios iniciais de formação do etanol. As moléculas de dióxido de carbono flutuam na superfície do cobre e então se dobram para aceitar os átomos de hidrogênio das moléculas de água. Os experimentos de raios-X na fonte de luz avançada do Berkeley Lab ajudaram os pesquisadores a entender o papel do oxigênio subterrâneo neste processo. Crédito:Berkeley Lab
Ao usar raios-X para estudar os estágios iniciais de um processo químico que pode reformular o dióxido de carbono em compostos mais úteis, incluindo combustíveis líquidos, os pesquisadores ficaram surpresos quando o experimento lhes ensinou algo novo sobre o que impulsiona essa reação.
Uma técnica de raios-X no Laboratório Nacional Lawrence Berkeley do Departamento de Energia (Berkeley Lab), juntamente com o trabalho teórico de uma equipe do California Institute of Technology, Pasadena (Caltech), revelou como os átomos de oxigênio embutidos muito perto da superfície de uma amostra de cobre tiveram um efeito mais dramático nos estágios iniciais da reação com o dióxido de carbono do que as teorias anteriores poderiam explicar.
Essas informações podem ser úteis no projeto de novos tipos de materiais para aprimorar ainda mais as reações e torná-los mais eficientes na conversão de dióxido de carbono em outros produtos. Grandes concentrações de dióxido de carbono são prejudiciais à saúde e ao meio ambiente, portanto, os pesquisadores têm buscado maneiras de removê-lo da atmosfera e armazená-lo com segurança ou convertê-lo quimicamente em formas mais benéficas.
Para explicar o que estava acontecendo, a equipe de pesquisa desenvolveu modelos de computador, e revisou as teorias existentes para explicar o que eles estavam testemunhando nos experimentos. Seus resultados foram publicados online em 12 de junho no Proceedings of the National Academy of Sciences Diário.
O cobre é um catalisador comum - um material usado para ativar e acelerar reações químicas - e, embora não seja eficiente, auxilia na produção de etanol quando exposto ao dióxido de carbono e água. Na reação estudada, o cobre ajuda a quebrar e remontar quimicamente as moléculas de dióxido de carbono e água em outras moléculas.
"Encontramos mais do que pensávamos que iríamos encontrar nesta investigação fundamental, "disse Ethan Crumlin, um cientista do Advanced Light Source (ALS) do Berkeley Lab que co-liderou o estudo com os pesquisadores do Joint Center for Artificial Photosynthesis (JCAP) Junko Yano, no Berkeley Lab, e William Goddard III, na Caltech.
Os cientistas estão buscando maneiras de reduzir os níveis ambientalmente prejudiciais de dióxido de carbono das emissões de veículos e outras fontes, melhorando os processos químicos que convertem o gás dióxido de carbono em etanol (estrutura molecular mostrada aqui) para uso em combustíveis líquidos, por exemplo. Experimentos de raios-X no Berkeley Lab ajudaram a mostrar o que está em ação nos estágios iniciais das reações químicas que convertem dióxido de carbono e água em etanol. Crédito:Imagem composta / Wikimedia Commons
O ALS é uma instalação de pesquisa de raios-X conhecida como síncrotron que possui dezenas de linhas de feixe experimentais para explorar uma ampla gama de propriedades microscópicas na matéria, e o JCAP está focado em como converter dióxido de carbono, agua, e luz solar em combustíveis renováveis.
"Ter átomos de oxigênio logo abaixo da superfície - uma camada de subóxido - é um aspecto crítico para isso, "Crumlin disse. O trabalho de raios-X trouxe uma nova clareza na determinação da quantidade certa deste oxigênio subterrâneo - e seu papel nas interações com gás dióxido de carbono e água - para melhorar a reação.
"Compreendendo essa camada de subóxido, e o subóxido em contato com a água, é parte integrante de como a água interage com o dióxido de carbono "neste tipo de reação, ele adicionou.
Goddard e seus colegas da Caltech trabalharam em estreita colaboração com os pesquisadores do Berkeley Lab para desenvolver e refinar uma teoria da mecânica quântica que se encaixasse nas observações de raios-X e explicasse a estrutura eletrônica das moléculas na reação.
"Este foi um bom looping, processo interativo, - disse Crumlin. - Só estar curioso e não se contentar com uma resposta simples valeu a pena. Tudo começou a se juntar como uma história coesa. "
Goddard disse, "Este vaivém entre teoria e experimento é um aspecto estimulante da pesquisa moderna e uma parte importante da estratégia do JCAP para fazer combustíveis a partir do dióxido de carbono." A equipe do Caltech usou computadores para ajudar a entender como os elétrons e os átomos se reorganizam na reação.

Esta imagem de microscopia eletrônica de varredura em cores falsas mostra detalhes microscópicos na superfície de uma folha de cobre que foi usada como catalisador em uma reação química estudada na fonte de luz avançada do Berkeley Lab. A barra de escala representa 50 mícrons, ou milionésimos de um metro. Crédito:Berkeley Lab
No ALS do Berkeley Lab, pesquisadores recrutaram uma técnica de raios-X conhecida como APXPS (espectroscopia de fotoelétrons de raios-X de pressão ambiente, pois expuseram uma folha fina de cobre especialmente tratado - conhecido como Cu (111) - a gás dióxido de carbono e água adicionada em temperatura ambiente.
Em experimentos posteriores, eles aqueceram a amostra ligeiramente em oxigênio para variar a concentração de oxigênio embutido na folha, e usou raios-X para investigar os estágios iniciais de como o dióxido de carbono e a água reagem sinergicamente com diferentes quantidades de óxido subterrâneo na superfície do cobre.
Os estudos de raios-X, planejado e executado por Marco Favaro, o principal autor do estudo, revelou como as moléculas de dióxido de carbono colidem com a superfície do cobre, em seguida, passe o mouse sobre ele em um estado de limite fraco. As interações com as moléculas de água servem para dobrar as moléculas de dióxido de carbono de uma forma que lhes permite retirar os átomos de hidrogênio das moléculas de água. Este processo eventualmente forma etanol, um tipo de combustível líquido.
"A modesta quantidade de oxigênio subterrâneo ajuda a gerar uma mistura de cobre metálico e carregado que pode facilitar a interação com o dióxido de carbono e promover outras reações quando na presença de água, "Crumlin disse.
O cobre tem algumas deficiências como catalisador, Yano notou, e atualmente é difícil controlar o produto final que um determinado catalisador irá gerar.
"Se sabemos o que a superfície está fazendo, e qual é o modelo para esta interação química, então há uma maneira de imitar isso e melhorá-lo, "Yano disse. O trabalho em andamento também pode ajudar a prever a produção final de um determinado catalisador em uma reação." Nós sabemos que o cobre funciona - e as diferentes superfícies de cobre, ligas de cobre, ou diferentes tipos de metais e ligas? "