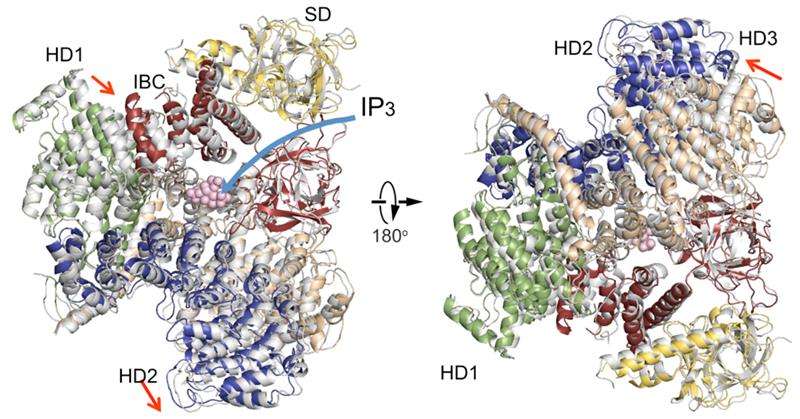
Uma comparação de estruturas de domínio citosólico IP3R na ausência de IP3 (colorido) com uma na presença de IP3 (cinza). Organização do domínio. Domínio supressor (SD), amarelo; Núcleo de ligação IP3 (IBC), vermelho; domínio helicoidal 1 (HD1), verde; domínio helicoidal 2 (HD2), azul; domínio helicoidal 3, trigo. Crédito:RIKEN
Pesquisadores do RIKEN Brain Science Institute determinaram a estrutura de resolução atômica de uma molécula-chave que traduz os sinais do ambiente local de uma célula em uma linguagem que a célula pode entender e usar. A determinação da arquitetura do receptor tris-fosfato de inositol (IP3R) há muito tempo é considerada um dos principais objetivos da pesquisa biomédica devido ao seu papel estratégico dentro das células como uma estação de trem molecular para a transferência de sinais que controlam muitas funções celulares.
Culminando um esforço de quase 10 anos, pesquisadores determinaram a estrutura de resolução atômica de uma molécula-chave que traduz os sinais do ambiente local de uma célula em uma linguagem que a célula pode entender e usar. A determinação da arquitetura do receptor tris-fosfato de inositol (IP3R) há muito tempo é considerada um dos principais objetivos da pesquisa biomédica devido ao seu papel estratégico dentro das células como uma estação de trem molecular para a transferência de sinais que controlam muitas funções celulares. Espera-se que a estrutura contribua para o desenvolvimento de melhores abordagens terapêuticas para muitas doenças. O trabalho foi conduzido por uma equipe do RIKEN Brain Science Institute sob a direção do Professor Katsuhiko Mikoshiba, cujo laboratório clonou o primeiro gene IP3R em 1989.
Em todas as células vivas, sinais químicos são aproveitados para comunicação intracelular. O inositol 1, 4, O 5-trifosfato (IP3) é um sinal que se liga ao receptor IP3 (IP3R) para liberar íons cálcio (Ca2 +) dos estoques intracelulares de Ca2 +, como o retículo endoplasmático. Os estoques de Ca2 + embutidos em IP3R são distribuídos em vários microdomínios dentro das células e têm papéis essenciais em processos tão diversos como a comunicação neural, diferenciação, plasticidade, e metabolismo. Dos três genes identificados, o IP3R tipo 1 dominante no cérebro (IP3R1) é geneticamente causador de ataxia espinocerebelar 15/16/29 e síndrome de Gillespie, e regula os processos de eliminação de resíduos celulares implicados na etiologia de doenças neurodegenerativas, incluindo a doença de Alzheimer. Embora os papéis importantes do IP3R em condições normais e de doença sejam bem conhecidos, entender como os sinais IP3 acionam a abertura do canal de Ca2 + era difícil de entender.
A nova estrutura cristalina IP3R1 revela um rico cosmos de detalhes em escala atômica sobre sua função. IP3R1 é uma micro-máquina de 20 nm de diâmetro que contém duas subestruturas funcionais, um sítio de ligação IP3 e um poro de canal de Ca2 +. A distância do local de ligação IP3 ao poro do canal é de 7 nm, o mais longo entre os canais iônicos semelhantes, e a questão fundamental de como a ligação ao IP3 abre fisicamente o canal a uma longa distância não foi respondida nas décadas desde que o gene foi clonado. Cristalografia de raios-X do grande domínio citosólico de um rato IP3R1 na ausência e presença de IP3, na fábrica de feixes de íons RIKEN SPring-8, identificou um mecanismo de longo alcance envolvendo um movimento global dependente de IP3 de uma parte do receptor chamado domínio da curvatura α-helicoidal que serve como uma ponte entre os domínios citosólico e do canal. A mutagênese desta ponte revelou o papel essencial de uma estrutura de folheto no domínio α-helicoidal que retransmite sinais IP3 para o canal, e pode ajudar a explicar como ocorre o acoplamento de longo alcance da ligação de IP3 ao canal de Ca2 +.
Os resultados revelam semelhanças e diferenças com um relatório publicado recentemente sobre o IP3R usando um método completamente diferente chamado microscopia crioeletrônica. No estudo relacionado, um grupo liderado por Irina Serysheva do Centro de Ciências da Saúde da Universidade do Texas em Houston propôs que a ativação do canal por IP3 pode ocorrer por ligação direta do terminal C e domínio de ligação de IP3 e acoplamento do domínio de ligação de IP3 a subunidades vizinhas. Os dados atuais discordam dessas conclusões, em vez disso, sugerindo que o sítio de ligação de IP3 à região do folheto está subjacente às mudanças estruturais dinâmicas por IP3. Uma comparação das duas estruturas revela concordância em uma parte imóvel do domínio helicoidal da curvatura e um arranjo variável de outros domínios helicoidais. Os autores levantam a hipótese de que a seção imóvel agiria como um corpo rígido conduzindo um torque dos locais de ligação de IP3 para o domínio do canal, enquanto as regiões flexíveis contribuiriam para as propriedades dinâmicas da função IP3R.
Resolver o mistério de longa data da comunicação de longo alcance que permite ao IP3 abrir o canal ajudará no futuro design racional de drogas visando o receptor que poderia permitir uma gama mais diversificada de vias terapêuticas. As descobertas também podem esclarecer os papéis do IP3R na senescência celular e na supressão de tumor ligada à vulnerabilidade seletiva das células cancerosas. Surpreendentemente, o estudo também esclarece o papel dos IP3Rs na função de organismos unicelulares patogênicos como o Trypanosoma cruzi, o parasita da doença de Chagas, e brucei, que causa tripanossomíase africana ou doença do sono. A equipe identificou uma sequência de aminoácidos no folheto que é conservada em parasitas, sugerindo percepções estruturais que podem auxiliar na descoberta de medicamentos para essas condições devastadoras.