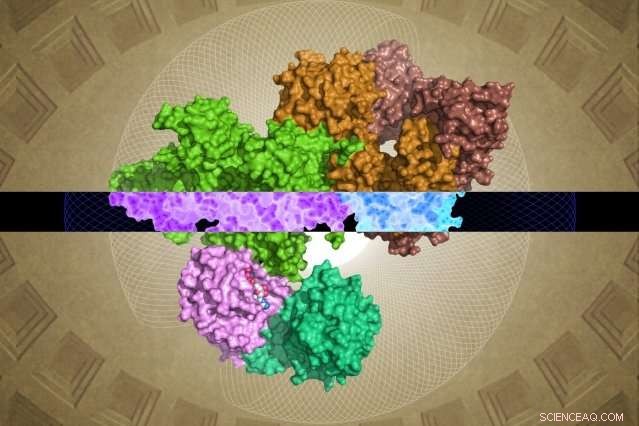
A estrutura GATOR1 gerada por crio-EM pode fornecer informações sobre sua função. Crédito:Steven Lee / Whitehead Institute
Uma equipe de pesquisadores do Whitehead Institute e do Howard Hughes Medical Institute revelou a estrutura de um complexo de proteínas-chave em humanos que transmite sinais sobre os níveis de nutrientes, permitindo que as células alinhem seu crescimento com o suprimento de materiais necessários para dar suporte a esse crescimento. Este complexo, chamado GATOR1, atua como uma espécie de interruptor liga-desliga para os sinais de "crescimento" (ou "não crescimento") que fluem através de uma via crítica de crescimento celular conhecida como mTORC1.
Apesar de sua importância, GATOR1 tem pouca semelhança com proteínas conhecidas, deixando grandes lacunas na compreensão dos cientistas sobre sua estrutura e função molecular. Agora, conforme descrito online em 28 de março na revista Natureza , Cientistas de Whitehead e seus colegas geraram a primeira imagem molecular detalhada de GATOR1, revelando um grupo altamente ordenado de proteínas e uma interação extremamente incomum com seu parceiro, o Rag GTPase.
"Se você sabe algo sobre a estrutura tridimensional de uma proteína, então, você pode fazer algumas suposições sobre como isso pode funcionar. Mas GATOR1 tem sido basicamente uma caixa preta, "diz o autor sênior David Sabatini, um membro do Instituto Whitehead, um professor de biologia no MIT, e pesquisador do Howard Hughes Medical Institute (HHMI). "Agora, pela primeira vez, geramos imagens de alta resolução de GATOR1 e podemos começar a dissecar como funciona esse complexo de proteínas críticas. "
GATOR1 foi identificado pela primeira vez há cerca de cinco anos. Consiste em três subunidades de proteínas (Depdc5, Nprl2, e Nprl3), e mutações nessas subunidades foram associadas a doenças humanas, incluindo câncer e condições neurológicas, como epilepsia. Contudo, por causa da falta de semelhança com outras proteínas, a maior parte do complexo GATOR1 é um mistério molecular. "GATOR1 não tem domínios de proteína bem definidos, "explica o pesquisador Kuang Shen de Whitehead, um dos primeiros autores do estudo. "Então, este complexo é realmente muito especial e também muito desafiador para estudar. "
Por causa do grande tamanho do complexo e flexibilidade relativa, GATOR1 não pode ser cristalizado prontamente - uma etapa necessária para resolver a estrutura da proteína por meio do padrão, Métodos cristalográficos de raios-X. Como resultado, Shen e Sabatini procuraram Zhiheng Yu do HHMI. Yu e sua equipe são especializados em microscopia crioeletrônica (crio-EM), uma técnica emergente que promete visualizar as estruturas moleculares de grandes proteínas e complexos de proteínas. Mais importante, não utiliza cristais de proteína. Em vez de, as proteínas são rapidamente congeladas em uma fina camada de gelo vitrificado e, em seguida, fotografadas por um feixe de elétrons rápidos dentro de uma coluna de microscópio eletrônico.
"Houve alguns avanços importantes na tecnologia crio-EM na última década, e agora, é possível atingir a resolução atômica ou quase atômica para uma variedade de proteínas, "explica Yu, um autor sênior do artigo e diretor de HHMI's compartilhados, instalação de crio-EM de última geração no Campus de Pesquisa Janelia. O Prêmio Nobel de Química do ano passado foi concedido a três cientistas por seus esforços pioneiros para desenvolver crio-EM.
GATOR1 provou ser um assunto complicado, mesmo para crio-EM, e exigiu algumas tentativas e erros por parte de Yu, Shen, e seus colegas para preparar amostras que poderiam render informações estruturais robustas. Além disso, o trabalho da equipe foi dificultado ainda mais pela forma única do complexo. Sem nenhuma idéia da estrutura potencial do GATOR1, Shen e seus colegas, incluindo o co-autor Edward Brignole do MIT, teve que derivá-lo completamente do zero.
No entanto, a equipe Whitehead-HHMI foi capaz de resolver estruturas quase completas para GATOR1, bem como para GATOR1 ligado a suas proteínas parceiras, as Rag GTPases. (Duas regiões da subunidade Depdc5 são altamente flexíveis e, portanto, não puderam ser resolvidas.) A partir dessa riqueza de novas informações, bem como das análises bioquímicas subsequentes da equipe, algumas descobertas surpreendentes surgiram.
O primeiro é o notável nível de organização do GATOR1. A proteína é extremamente bem organizada, o que é bastante incomum para proteínas que não têm estruturas previstas. (Essas proteínas são geralmente bastante desorganizadas.) Além disso, os pesquisadores identificaram quatro domínios de proteína que nunca antes foram visualizados. Esses novos motivos - chamados de NTD, SABA, SHEN, e CTD - podem fornecer informações cruciais sobre o funcionamento interno do complexo GATOR1.
Shen, Sabatini, e seus colegas descobriram outra surpresa. Ao contrário de outras proteínas que se ligam a Rag GTPases, GATOR1 contata essas proteínas em pelo menos dois locais distintos. Além disso, um dos locais de ligação serve para inibir - em vez de estimular - a atividade da Rag GTPase. "Este tipo de ligação dupla nunca foi observado - é altamente incomum, "Shen diz. Os pesquisadores levantam a hipótese de que esse recurso é um dos motivos pelos quais GATOR1 é tão grande - porque ele deve conter sua Rag GTPase em vários locais, ao invés de um, como a maioria das outras proteínas desse tipo.
Apesar dessas surpresas, os pesquisadores reconhecem que suas análises apenas começaram a arranhar a superfície do GATOR1 e os mecanismos pelos quais ele regula a via de sinalização do mTOR.
"Ainda há muito a descobrir nesta proteína, "Sabatini diz.
Esta história foi republicada por cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisas do MIT, inovação e ensino.