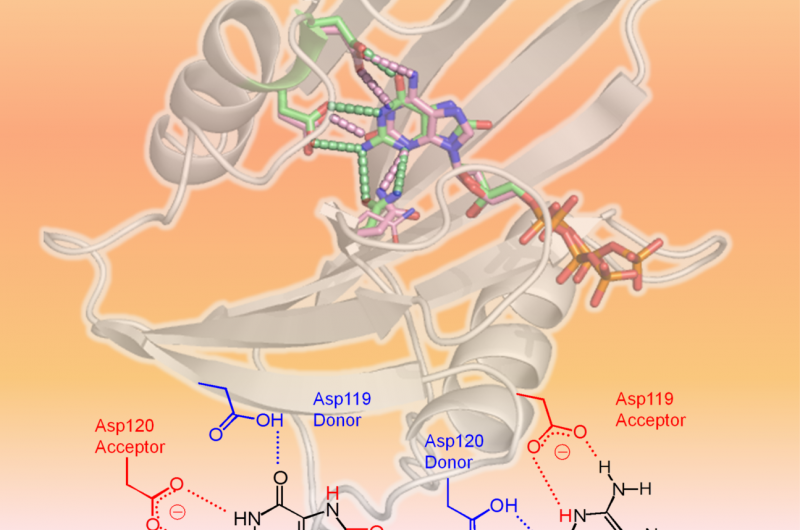
hMTH1 reconhece dois dNTPs oxidados, conforme mostrado na estrutura 3-D (área superior da figura:hMTH1, fita; dNTPs danificados, Gravetos). O fator determinante na ampla especificidade do substrato são os diferentes estados de protonação entre Asp-119 e Asp-120 (área inferior da figura). Crédito:Professora Yuriko Yamagata
A proteína Human MutT homólogo 1 (hMTH1) atua como a enzima primária para quebrar (hidrolisar) desoxinucleosídeo trifosfatos danificados (oxidados) (dNTPs) os substratos da síntese de DNA. Recentemente, hMTH1 chamou a atenção como um alvo popular para novas terapias anticâncer porque não é essencial para células normais, mas as células cancerosas exigem para evitar a incorporação de nucleotídeos oxidados no DNA, o que resultaria na morte das células cancerosas. Agora, Os inibidores de hMTH1 são desenvolvidos como candidatos a drogas anticâncer. Embora alguns relatórios argumentem contra a utilidade da inibição de hMTH1, inibidores altamente potentes e seletivos de hMTH1, que permitiria a introdução de nucleotídeos oxidados no DNA de células cancerosas, são esperados para o futuro tratamento do câncer.
As enzimas são geralmente muito específicas quanto ao material que catalisam (substrato). Algum, Contudo, pode catalisar mais de um substrato, e o hMTH1 é conhecido por hidrolisar vários dNTPs oxidados. As razões por trás da ampla especificidade do substrato ainda não haviam sido exploradas quando os pesquisadores do Japão começaram a considerar a questão.
Cientistas da Universidade Kumamoto, os Institutos Nacionais de Ciência e Tecnologia Quântica e Radiológica, e a Universidade de Kyushu realizaram análises estruturais e cinéticas em hMTH1 para determinar os mecanismos por trás de sua capacidade de hidrolisar vários dNTPs mutagênicos oxidados, como 8-oxo-dGTP e 2-oxo-dATP, com eficiência semelhante. Seus experimentos encontraram evidências de que o estado de protonação entre os resíduos de aspartato Asp-119 e Asp-120 foi o fator determinante na ampla especificidade do substrato do hMTH1. Em outras palavras, a adição ou remoção de um ou mais prótons em Asp-119 ou Asp-120 é o que faz com que hMTH1 reconheça 8-oxo-dGTP ou 2-oxo-dATP. Isso permite que o hMTH1 hidrolise os dNTPs mutagênicos oxidados antes de serem usados para a síntese de DNA; O DNA que contém nucleotídeos oxidados causaria a morte das células cancerosas.
"Descobrimos que diferentes estados de protonação entre Asp-119 e Asp-120 são o sinal para o hMTH1 hidrolisar os nucleotídeos danificados. Se esta ação do hMTH1 puder ser suprimida, as células cancerosas acumulariam nucleotídeos danificados e, eventualmente, sofreriam apoptose, "disse o professor Yuriko Yamagata da Universidade de Kumamoto, líder do grupo de pesquisa. "O esclarecimento deste mecanismo deve ajudar no desenvolvimento de drogas anticâncer direcionadas ao hMTH1."