Adaptação Estrutural de uma Proteína ao Aumento do Estresse Metálico:Estrutura NMR de um Caracol Marinho Metalotioneína com um Domínio Adicional. Crédito:Wiley
Um tipo especial de pequena proteína rica em enxofre, metalotioneínas, têm uma capacidade extraordinária para ligar metais pesados. Uma equipe internacional de cientistas descobriu agora que a pervinca comum marinha, que é amplamente considerada uma iguaria, contém a maior versão da proteína já encontrada, com um domínio adicional de ligação ao cádmio e um terço maior de capacidade de desintoxicação. Conforme relatam no jornal Angewandte Chemie , esse recurso pode ajudar o caracol a sobreviver em ambientes poluídos por metais pesados.
Caracóis e lesmas são conhecidos por sua capacidade intrigante de acumular e desintoxicar metais pesados. Eles são até capazes de discriminar entre cádmio e cobre, como o último elemento é um elemento indispensável em seu metabolismo, enquanto o cádmio é tóxico. Eles desintoxicam o cádmio ligando-o às metalotioneínas, uma classe de pequenas proteínas ricas no aminoácido cisteína contendo enxofre. Oliver Zerbe, da Universidade de Zurique, Suíça, e Reinhard Dallinger da Universidade de Innsbruck, Áustria, e seus colegas em Barcelona, Espanha, investigar a evolução dessas proteínas como uma estratégia para adaptar os gastrópodes aos seus novos habitats - caramujos terrestres desenvolveram-se a partir de espécies marinhas, e teve que encontrar novas estratégias para lidar com as cargas mais elevadas de metais pesados no solo. Ambientes ainda mais severos são encontrados nas costas marítimas com seu abastecimento de água flutuante. Como os cientistas descobriram, o gastrópode marinho Littorina littorea (pervinca comum), que colonizou com muito sucesso as costas do Atlântico Norte, encontrou uma estratégia peculiar para uma desintoxicação ainda mais eficiente.
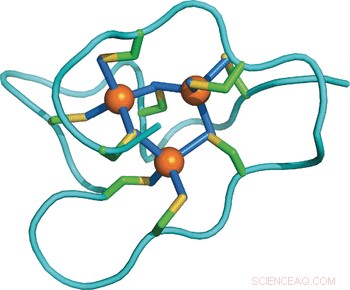
Estudar as diferenças moleculares entre as proteínas entre as várias espécies, os cientistas resolveram a estrutura da solução da metalotioneína da pervinca usando técnicas de ressonância magnética nuclear e compararam-na com outras estruturas e sequências conhecidas. Surpreendentemente, a proteína da pervinca compreende três domínios independentes, enquanto outras metalotioneínas conhecidas têm apenas um ou dois. Cada um dos três domínios contém nove resíduos de cisteína ligando-se a um grupo de três íons de cádmio, assim, o total de 27 resíduos de cisteína pode incorporar nove íons de cádmio. Isso lança luz sobre a estratégia de adaptação:"Aumentar o número de domínios simplesmente aumenta a capacidade de ligação de metal da proteína e, assim, potencializa sua capacidade de desintoxicação de metal, "escreveram os autores.
Em relação às características estruturais, o complexo formado com cádmio é muito semelhante ao da forma do caracol romano, que pode discriminar eficientemente entre os íons de cobre vitais para os caracóis e o cádmio tóxico. E além de simplesmente lidar com ambientes ricos em cádmio e selecionar cobre de outros metais pesados, as metalotioneínas ricas em cisteína são consideradas proteínas importantes de resposta ao estresse oxidativo. O estresse é um dos principais encontros da pervinca comum, que pode sobreviver a mares agitados e à seca ao mesmo tempo.