Potencial oculto dos RNAs:novo estudo revela seu papel no início da vida e na futura bioengenharia
 Pesquisadores da Universidade de Ciência de Tóquio projetaram uma estrutura de ribozima que imita o mundo primitivo do RNA e fornece novos insights sobre o papel do RNA na vida primitiva, para suas diversas aplicações no mundo real. Crédito:Professor Koji Tamura, Universidade de Ciências de Tóquio
Pesquisadores da Universidade de Ciência de Tóquio projetaram uma estrutura de ribozima que imita o mundo primitivo do RNA e fornece novos insights sobre o papel do RNA na vida primitiva, para suas diversas aplicações no mundo real. Crédito:Professor Koji Tamura, Universidade de Ciências de Tóquio O início da vida na Terra e a sua evolução ao longo de milhares de milhões de anos continuam a intrigar investigadores em todo o mundo. O dogma central ou o fluxo direcional de informação genética de um modelo de ácido nucleico desoxirribose (DNA) para um transcrito de ácido nucleico ribose (RNA) e, finalmente, para uma proteína funcional, é fundamental para a estrutura e funções celulares.
O DNA funciona como o modelo da célula e carrega informações genéticas necessárias para a síntese de proteínas funcionais. Por outro lado, as proteínas são necessárias para a síntese de DNA. Portanto, se o DNA surgiu primeiro ou a proteína continua a ser uma questão de debate.
Esta versão molecular da questão do “ovo e da galinha” levou à proposição de um “Mundo RNA”. Os RNAs na forma de “ribozimas”, ou enzimas de RNA, carregam informações genéticas semelhantes ao DNA e também possuem funções catalíticas como as proteínas.
A descoberta das ribozimas alimentou ainda mais a hipótese do Mundo do RNA, onde o RNA desempenhava funções duplas de "armazenamento de informação genética" e "catálise", facilitando atividades de vida primitivas exclusivamente pelo RNA. Embora os ribossomos modernos sejam um complexo de RNAs e proteínas, as ribozimas durante os primeiros estágios evolutivos podem ter sido reunidas através da montagem de unidades funcionais individuais de RNA.
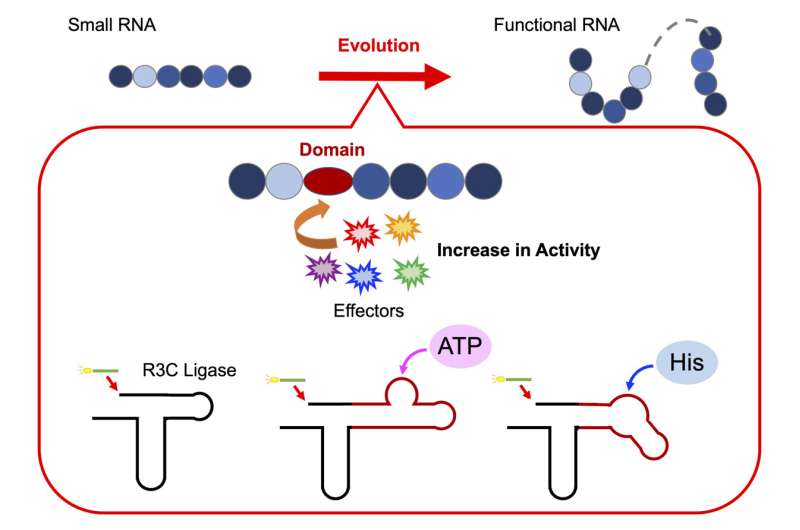
Para testar esta hipótese, o professor Koji Tamura, juntamente com a sua equipa de investigadores do Departamento de Ciência e Tecnologia Biológica da Universidade de Ciência de Tóquio, conduziram uma série de experiências para descodificar a montagem de ribozimas funcionais. Para isso, eles projetaram uma ribozima artificial, a ligase R3C, para investigar como unidades individuais de RNA se unem para formar uma estrutura funcional.
Seu trabalho é publicado na revista Life .
Dando mais informações sobre sua pesquisa, o Prof. Tamura afirma:"A ligase R3C é uma ribozima que catalisa a formação de uma ligação 3',5'-fosfodiéster entre duas moléculas de RNA. Modificamos a estrutura adicionando domínios específicos que podem interagir com vários efetores."
Dentro dos ribossomos, que são o local da síntese protéica, as unidades de RNA se reúnem para funcionar como centros de peptidil transferase (PTCs), de forma que formam uma estrutura para o recrutamento de aminoácidos (componentes individuais de um peptídeo/proteína) ligados aos tRNAs. .
Esta é uma visão importante sobre a história evolutiva dos sistemas de síntese de proteínas, mas não é suficiente para traçar o caminho evolutivo com base na hipótese do RNA World.
Para explorar se o alongamento do RNA, alcançado pela ligação de unidades individuais de RNA, é regulado alostericamente, os pesquisadores alteraram a estrutura da ligase R3C. Eles fizeram isso incorporando sequências curtas de RNA que ligam o trifosfato de adenosina (ATP), uma molécula transportadora de energia vital nas células, à ribozima. A equipe notou que a atividade da ligase R3C dependia da concentração de ATP, com maior atividade observada em concentrações mais altas de ATP.
Além disso, um aumento na temperatura de fusão (Tm valor) indicou que a ligação do ATP à ligase R3C estabilizou a estrutura, o que provavelmente influenciou sua atividade da ligase.
Da mesma forma, ao fundir uma sequência de RNA de ligação à L-histidina à ribozima, eles notaram um aumento na atividade da ligase em concentrações crescentes de histidina (um aminoácido chave). Notavelmente, o aumento na atividade foi específico para concentrações crescentes de ATP ou histidina; nenhuma alteração foi observada em resposta a outros trifosfatos de nucleotídeos ou aminoácidos.
Estas descobertas sugerem que o ATP e a histidina actuam como moléculas efectoras que desencadeiam alterações conformacionais estruturais na ribozima, que influenciam ainda mais a estabilidade e actividade da enzima.
O ATP é o transportador de energia central da célula que suporta numerosos processos moleculares, enquanto a histidina é o aminoácido mais comum encontrado no sítio ativo das enzimas e mantém sua química ácido-base. Dados os papéis importantes do ATP e da histidina nas interações do RNA e nas funções moleculares, estes resultados fornecem novos insights sobre o papel do RNA na evolução inicial, incluindo a origem do código genético.
Além disso, ribozimas projetadas como a desenvolvida neste estudo são promissoras em uma infinidade de aplicações, incluindo distribuição direcionada de medicamentos, terapêutica, nanobiossensores, engenharia enzimática e síntese de novas enzimas com uso em vários processos industriais.
No geral, este estudo pode oferecer insights sobre como ocorreu a transição do Mundo do RNA para o moderno “Mundo do DNA/Proteína”. Uma compreensão fundamental do mundo do RNA, por sua vez, pode melhorar a sua utilização em aplicações da vida real.
"Este estudo levará à elucidação do processo de 'aquisição de função e cooperatividade baseada na alostericidade' na evolução do RNA. As interações RNA-RNA, interações RNA-aminoácidos e alostericidade aplicadas nesta pesquisa podem orientar a fabricação de arbitrários Nanoestruturas de RNA, com diversas aplicações”, finaliza o Prof. Tamura.
