Testando o funcionamento dos biomarcadores:novo método de microscopia de fluorescência pode melhorar a resolução até a escala de Ångström
 Quantificação absoluta da eficiência de marcação de proteínas tag. Crédito:Métodos da Natureza (2024). DOI:10.1038/s41592-024-02242-5
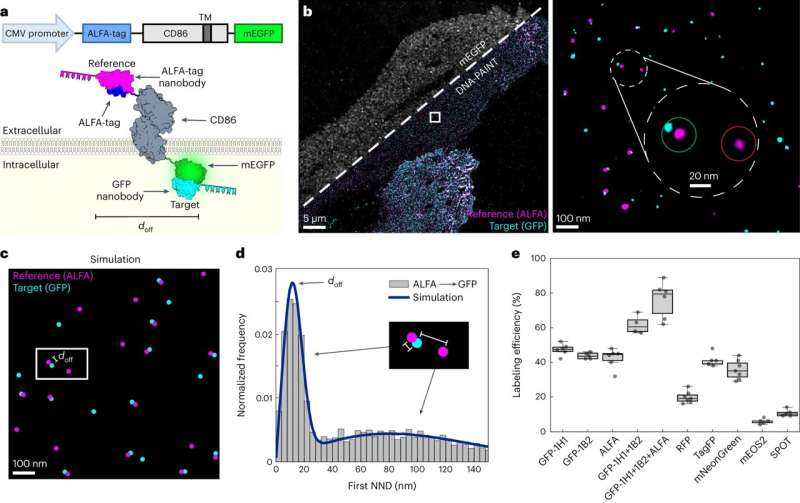
Quantificação absoluta da eficiência de marcação de proteínas tag. Crédito:Métodos da Natureza (2024). DOI:10.1038/s41592-024-02242-5 Os pesquisadores da LMU desenvolveram um método para determinar o quão confiável as proteínas alvo podem ser rotuladas usando microscopia de fluorescência de super-resolução.
As técnicas modernas de microscopia permitem examinar o funcionamento interno das células com detalhes surpreendentes. “Agora podemos observar o arranjo e a interação de proteínas individuais sob o microscópio”, diz o professor Ralf Jungmann, presidente de Física Molecular da Vida na LMU e Max Planck Fellow no MPI de Bioquímica.
A equipe do biofísico desenvolveu recentemente o revolucionário método RESI (Resolution Enhancement by Sequential Imaging). Esta técnica pode ser usada para melhorar a resolução da microscopia de fluorescência até a escala de Ångström – muito abaixo do limite clássico de difração da luz. Moléculas marcadoras conjugadas com DNA, que os pesquisadores ligam precisamente às moléculas que desejam compreender melhor, são cruciais para isso.
A equipe de Jungmann apresentou agora uma técnica na revista Nature Methods que pode ser usado para quantificar quão bem as moléculas de biomarcadores se ligam às proteínas alvo. “Isso é absolutamente crucial se você quiser fazer afirmações quantitativamente confiáveis”, explica o físico.
Se você conhece a eficiência da rotulagem, poderá realizar proteômica resolvida espacialmente dessa maneira. Isso permite descobrir não apenas o que as proteínas individuais fazem em uma célula, mas também até que ponto elas estão presentes e como sua quantidade e comportamento mudam sob determinadas circunstâncias. "Mas isso só será possível se pudermos avaliar até que ponto a rotulagem funcionou." Isso ocorre porque apenas as proteínas marcadas emitem flashes de luz ao microscópio e, assim, tornam-se visíveis.
O método desenvolvido pela equipe de Jungmann possibilita essa avaliação ao adicionar um biomarcador de referência às proteínas-alvo. Este marcador “brilha” em uma cor diferente durante a microscopia, de modo que as proteínas marcadas com sucesso aparecem em duas cores.
A equipe de Jungmann demonstrou isso usando a proteína de membrana CD86, entre outras:a referência produz uma fluorescência rosa, o marcador real, uma fluorescência azulada. Isso cria um padrão de inúmeros pontos de luz rosa e azul. Onde a marcação não funcionou, apenas a referência acende individualmente. A eficiência de marcação é calculada a partir da proporção de moléculas iluminadas duplas e simples.
O método oferece diversas vantagens em comparação aos métodos anteriores para determinar a eficiência de ligação:“Funciona não apenas in vitro, mas também in vivo, ou seja, no contexto de células intactas”, explica Jungmann. "A técnica também pode ser aplicada a uma variedade de diferentes moléculas-alvo, biomarcadores e amostras e é compatível com toda uma gama de métodos de super-resolução."
Um meio confiável e amplamente aplicável de avaliar a eficiência do marcador é crucial para garantir uma avaliação precisa dos dados e permitir comparações confiáveis entre diferentes aglutinantes, condições de rotulagem e laboratórios de pesquisa.
Os autores do estudo estão certos de que o novo método de quantificação abriu caminho para expandir significativamente o potencial do seu método de microscópio de super-resolução:"Agora também podemos considerar aplicações biomédicas específicas nas quais a detecção quantitativa de proteínas e processos é de grande importância. importância", diz Jungmann.
Isso inclui pesquisas sobre câncer, por exemplo, onde informações sobre interações entre proteínas da superfície celular e medicamentos com resolução molecular são essenciais para o desenvolvimento de novos tipos de medicamentos.
