Descobertas de telômeros que desafiam dogmas podem oferecer novos insights para tratamentos de câncer
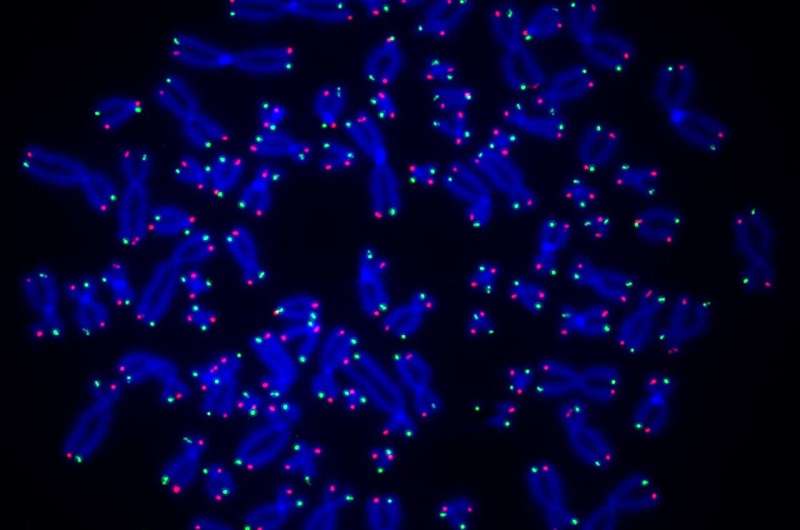 Visualização dos telômeros (vermelho e verde) nas extremidades dos cromossomos humanos (azul). Crédito:Laboratório O'Sullivan
Visualização dos telômeros (vermelho e verde) nas extremidades dos cromossomos humanos (azul). Crédito:Laboratório O'Sullivan Um novo estudo liderado por pesquisadores da Universidade de Pittsburgh e do UPMC Hillman Cancer Center mostra que uma enzima chamada PARP1 está envolvida no reparo dos telômeros, os comprimentos de DNA que protegem as pontas dos cromossomos, e que prejudicar esse processo pode levar ao encurtamento dos telômeros e à destruição genômica. instabilidade que pode causar câncer.
A função do PARP1 é a vigilância do genoma:quando detecta quebras ou lesões no ADN, adiciona uma molécula chamada ADP-ribose a proteínas específicas, que actuam como um farol para recrutar outras proteínas que reparam a quebra. As novas descobertas, publicadas na Nature Structural &Molecular Biology , são a primeira evidência de que a PARP1 também atua no DNA telomérico, abrindo novos caminhos para a compreensão e melhoria das terapias contra o câncer inibidoras da PARP1.
"Ninguém pensava que a ribosilação de ADP no DNA fosse possível, mas descobertas recentes desafiam esse dogma", disse Roderick O'Sullivan, Ph.D., professor associado de farmacologia molecular Pitt e investigador da UPMC Hillman. “A PARP1 é um dos alvos biomédicos mais importantes para a investigação do cancro, mas pensava-se que os medicamentos que visavam esta enzima agiam apenas nas proteínas. Agora que sabemos que a PARP1 também modifica o ADN, isso muda o jogo porque podemos potencialmente atingir este aspecto da PARP1 biologia para melhorar os tratamentos contra o câncer."
Nas células normais, as lesões genômicas ocorrem naturalmente durante a replicação do DNA, quando uma célula se divide, e a PARP1 desempenha um papel importante na correção desses erros. Mas embora as células saudáveis tenham outras vias de reparação do ADN às quais recorrer, os cancros deficientes em BRCA – que incluem muitos tumores da mama e dos ovários – dependem fortemente da PARP1 porque não possuem proteínas BRCA, que controlam a forma mais eficaz de reparação do ADN chamada replicação homóloga.
“Quando as células cancerígenas não conseguem produzir proteínas BRCA, tornam-se dependentes das vias de reparação nas quais a PARP1 está envolvida”, disse O'Sullivan. “Então, quando você inibe a PARP1 – que é o mecanismo de vários medicamentos contra o câncer aprovados – as células cancerígenas não têm nenhuma via de reparo disponível e morrem”.
Embora os cientistas tenham descoberto o papel da PARP1 na ribosilação de ADP de proteínas há cerca de 60 anos, O'Sullivan e seu colaborador, Ivan Ahel, Ph.D., professor da Escola de Patologia Sir William Dunn da Universidade de Oxford e especialista em PARP1, tive um palpite de que havia mais para aprender sobre essa enzima e seu papel nas células.
O'Sullivan e sua equipe, liderada por Anne Wondisford, Ph.D., estudante de pós-graduação no Programa de Treinamento Médico-Cientista de Pitt, compararam pela primeira vez células humanas normais com aquelas deficientes em PARP1. Usando anticorpos especiais que se ligam a sondas ADP-ribose e específicas de telômeros, eles descobriram que a ADP-ribose se liga ao DNA telomérico em células normais, mas não em células deficientes em PARP1, mostrando que esta enzima é responsável pela ribosilação de ADP do DNA.
Em seguida, compararam células normais com aquelas deficientes em outra enzima chamada TARG1, que remove ADP-ribose. Na ausência de TARG1, a ADP-ribose acumulou-se nos telômeros, levando à interrupção da replicação dos telômeros e ao encurtamento prematuro dos telômeros.
Para mostrar que esses defeitos nos telômeros eram devidos à modificação do DNA telomérico, O'Sullivan e sua equipe pegaram enzimas bacterianas que funcionam de forma semelhante à PARP1 e as colocaram em células humanas.
"Usamos um sistema de orientação para direcionar as enzimas para adicionar ADP-ribose apenas nos telômeros e em nenhum outro lugar do genoma", disse O'Sullivan. “Descobrimos que se carregarmos os telômeros com ADP-ribose, sua integridade é drasticamente prejudicada e pode matar a célula em poucos dias”.
O'Sullivan levanta a hipótese de que a ADP-ribose afeta a integridade dos telômeros ao romper uma estrutura protetora chamada abrigo que protege os telômeros, mas são necessárias mais pesquisas para confirmar isso.
“A segmentação da PARP1 tem sido uma grande história de sucesso para a terapia do câncer, mas alguns pacientes desenvolvem resistência aos inibidores da PARP1”, disse O'Sullivan. “Estou entusiasmado com este estudo porque descobrimos algo novo sobre a biologia da PARP1, o que gera uma série de novas questões que podem nos ajudar a desenvolver novas abordagens para atingir a PARP1 ou ajustar as terapias que já temos. no início de algo emocionante, e há muito mais para explorar."
Outros autores do estudo foram Sandra Schamus-Haynes, Ragini Bhargava Ph.D., e Patricia Opresko, Ph.D., todas da Pitt e UPMC; Junyeop Lee e Jaewon Min, Ph.D., ambos da Universidade de Columbia; Robert Lu, Ph.D., e Hilda Pickett, Ph.D., ambos da Universidade de Sydney; e Marion Schuller, D.Phil., e Josephine Groslambert, ambas da Universidade de Oxford.
