Pesquisa de montagem de proteínas mostra que o lançamento molecular dos dados oferece combinações vencedoras
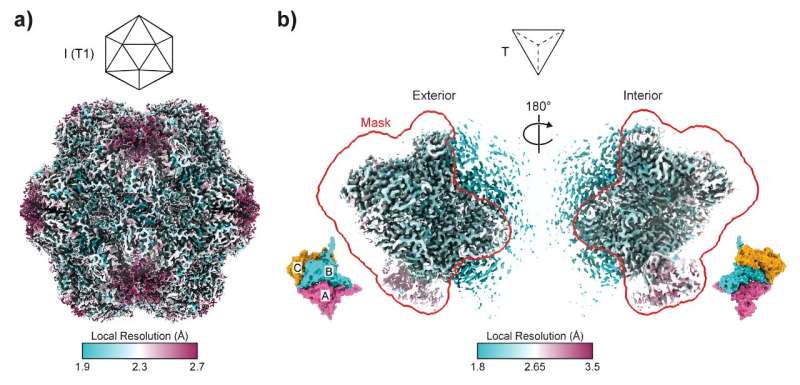 Estimativa de resolução local de mapas crio-EM. a) Estimativa para a montagem icosaédrica T=1 de 3×His-MxEnc com base em um limite FSC de 0,143. b) Estimativa da unidade assimétrica (ASU) da montagem tetraédrica de 3×His-MxEnc com base em um limite FSC de 0,143. A máscara de refinamento usada para refinamento local mascarado está destacada em vermelho. A orientação do mapa ASU é indicada por um modelo ASU colorido por um protômero ASU exclusivo (A:rosa, B:ciano, C:ouro). Crédito:Anais da Academia Nacional de Ciências (2024). DOI:10.1073/pnas.2321260121
Estimativa de resolução local de mapas crio-EM. a) Estimativa para a montagem icosaédrica T=1 de 3×His-MxEnc com base em um limite FSC de 0,143. b) Estimativa da unidade assimétrica (ASU) da montagem tetraédrica de 3×His-MxEnc com base em um limite FSC de 0,143. A máscara de refinamento usada para refinamento local mascarado está destacada em vermelho. A orientação do mapa ASU é indicada por um modelo ASU colorido por um protômero ASU exclusivo (A:rosa, B:ciano, C:ouro). Crédito:Anais da Academia Nacional de Ciências (2024). DOI:10.1073/pnas.2321260121 Pesquisadores australianos lançaram luz sobre as capacidades de mudança de forma dos conjuntos de proteínas, com resultados que poderiam revolucionar campos desde a biofabricação até o desenvolvimento de vacinas.
Liderada pelo Dr. mergulha no intrincado mundo das encapsulinas. Essas gaiolas de proteínas icosaédricas desempenham um papel crucial na fabricação de nanorreatores, com seus poros agindo como portas para pequenas nanofábricas.
“Ao manipular os poros e alterar seu tamanho e carga, podemos ter melhor controle sobre os substratos que entram nas gaiolas e são transformados em produtos pelas enzimas embaladas dentro delas”, diz o Dr.
No entanto, a exploração da equipa tomou um rumo inesperado quando começaram a fazer pequenas mutações para observar os efeitos.
Este lançamento de dados moleculares levou à criação de estruturas semelhantes a tetraedros, uma forma de pirâmide muito diferente das habituais encapsulinas esféricas. Em termos de forma de montagem, é como transformar um dado de 20 lados em um dado de quatro lados. Esses conjuntos tetraédricos, compreendendo apenas 36 subunidades proteicas em comparação com as 180 usuais, abrem um reino de possibilidades anteriormente inexploradas na engenharia de proteínas
“O que descobrimos é que são necessárias mutações mínimas para mudar drasticamente a forma da montagem final”, diz o Dr. "Esperávamos que fosse um processo muito mais complicado."
As descobertas do estudo não apenas desafiam o entendimento existente sobre a montagem de proteínas, mas também oferecem insights sobre a biologia evolutiva. As encapsulinas, embora não sejam vírus em si, compartilham laços evolutivos com estruturas virais. Os investigadores especulam que a flexibilidade observada nas encapsulinas pode ser atribuída ao seu menor tamanho de carga em comparação com os vírus, influenciando potencialmente a sua capacidade de adotar diversas formas.
"Esta descoberta sugere que existem outras formas que podemos criar, com amplas implicações para a bioengenharia e a biofabricação", diz o Dr. Szyszka.
Com mais investigação, a equipa espera desbloquear todo o potencial destas proteínas que mudam de forma, abrindo caminho para inovações que poderão remodelar as indústrias e melhorar a saúde humana.
