Nova estratégia suprime eventos de exclusão indesejados para tornar a edição do genoma mais segura e precisa
 Uma nova estratégia inovadora fortalece a edição CRISPR, minimizando grandes exclusões e aumentando a segurança e a precisão nas modificações genéticas. Crédito:KAUST
Uma nova estratégia inovadora fortalece a edição CRISPR, minimizando grandes exclusões e aumentando a segurança e a precisão nas modificações genéticas. Crédito:KAUST Uma estratégia simples e robusta desenvolvida pelos cientistas da KAUST poderia ajudar a melhorar a segurança e a precisão da edição genética CRISPR, uma ferramenta que já está aprovada para uso clínico no tratamento de doenças hereditárias do sangue.
Esta abordagem aborda uma questão crítica da tecnologia CRISPR:o ato de fatiar o genoma em pontos específicos e depois juntá-lo, o que inerentemente corre o risco de danificar o ADN de uma forma que pode causar perturbações imprevisíveis e em grande escala.
Na esperança de mitigar este problema, uma equipe liderada por Mo Li, biólogo de células-tronco da KAUST, investigou vias de reparo de DNA que levam a grandes deleções genômicas após edição CRISPR em células-tronco humanas. O estudo foi publicado na revista BMC Biology .
A sua análise levou-os a um processo conhecido como junção final mediada por microhomologia (MMEJ), um mecanismo propenso a erros que, embora seja capaz de corrigir quebras no ADN, muitas vezes deixa grandes eliminações no seu rasto.
Os investigadores interrogaram vários genes implicados neste processo MMEJ e descobriram dois que desempenhavam papéis centrais – mas opostos – nestes eventos de eliminação indesejados.
Um gene, chamado POLQ, acabou exacerbando o risco de grandes exclusões após a edição CRISPR. O outro, denominado RPA, surgiu como guardião genômico com efeitos protetores.
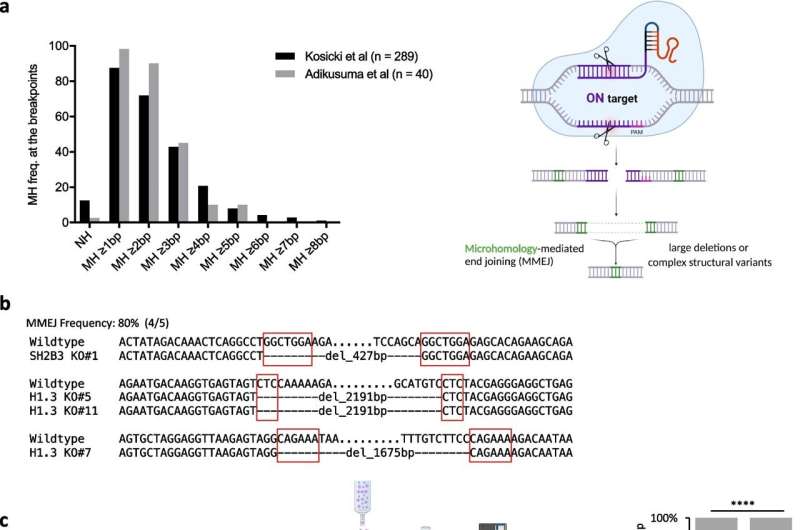 A modulação da via de união de extremidades mediada por microhomologia suprime grandes deleções e melhora o reparo direcionado por homologia após quebras de DNA induzidas por CRISPR-Cas9. Crédito:BMC Biologia (2024). DOI:10.1186/s12915-024-01896-z
A modulação da via de união de extremidades mediada por microhomologia suprime grandes deleções e melhora o reparo direcionado por homologia após quebras de DNA induzidas por CRISPR-Cas9. Crédito:BMC Biologia (2024). DOI:10.1186/s12915-024-01896-z
Ao manipular esses genes, seja com medicamentos que inibem o POLQ ou através de técnicas genéticas que aumentam a expressão do RPA, a equipe da KAUST foi então capaz de reduzir a ocorrência de grandes deleções prejudiciais sem comprometer a eficiência da edição do genoma e, ao fazê-lo, preservar a integridade genômica das células-tronco editadas.
“Essa abordagem fácil de usar pode reduzir as chances de ocorrência dessas grandes exclusões prejudiciais de DNA”, diz Baolei Yuan, ex-Ph.D. estudante do laboratório de Li e um dos arquitetos do estudo, junto com Chongwei Bi e Yeteng Tian do laboratório de Li.
Além disso, descobriu-se que estas mesmas intervenções aumentam a eficiência da reparação dirigida por homologia, um mecanismo conhecido pela sua capacidade de permitir a edição precisa do genoma sem adicionar mutações indesejadas.
Isto ficou evidente em experiências envolvendo células estaminais que transportavam mutações em dois genes ligados à doença falciforme e à síndrome de Wiskott-Aldrich, ambas doenças hereditárias do sangue. Ao modular POLQ ou RPA, os pesquisadores alcançaram uma edição genética altamente precisa e confiável nessas células.
As descobertas marcam um avanço significativo no refinamento da tecnologia CRISPR, afirma Li. “É realmente emocionante porque significa que estamos cada vez mais perto de tratamentos mais seguros e eficazes para doenças genéticas”, diz ele.
Com um pedido de patente provisório apresentado para esta estratégia inovadora, a equipe continua a explorar os mecanismos por trás de uma gama mais ampla de mutações indesejáveis e a aprimorar suas técnicas para tornar o CRISPR mais seguro e eficiente.
“Alcançar alta eficiência e segurança continua sendo um desafio que requer maior desenvolvimento”, diz Li, “e nosso laboratório permanece na vanguarda, buscando novas soluções”.

