Pesquisadores revelam estrutura dinâmica das proteínas FLVCR e sua função no transporte de nutrientes
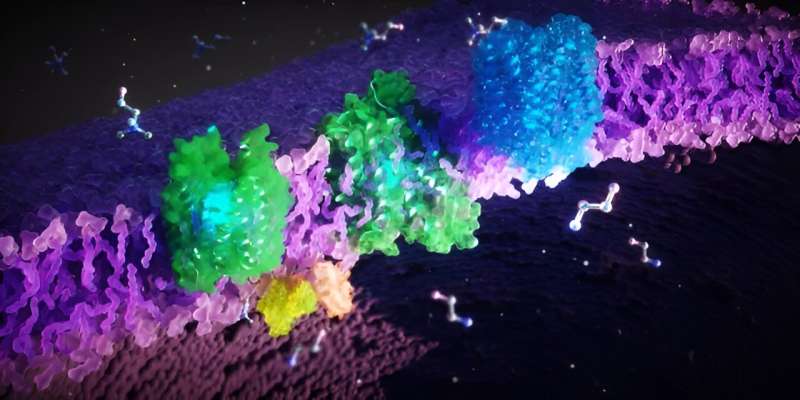 Proteínas FLVCR (verde, azul) situadas na membrana celular (roxo). Essas proteínas transportam os blocos de construção celular etanolamina e colina através da membrana. Crédito:Ella Maru Studio
Proteínas FLVCR (verde, azul) situadas na membrana celular (roxo). Essas proteínas transportam os blocos de construção celular etanolamina e colina através da membrana. Crédito:Ella Maru Studio Sabe-se que o mau funcionamento das proteínas FLVCR1 e FLVCR2 leva a doenças hereditárias raras em humanos que causam distúrbios motores, sensoriais e neurológicos. No entanto, os mecanismos bioquímicos por trás disso e as funções fisiológicas das proteínas FLVCR não são claros até o momento.
Uma equipe interdisciplinar de pesquisadores de Frankfurt am Main, Cingapura e dos EUA decifrou agora as estruturas 3D das proteínas FLVCR e suas funções celulares. Os pesquisadores demonstraram que as proteínas transportam os blocos de construção celular colina e etanolamina. As suas descobertas contribuem significativamente para a compreensão da patogénese das doenças raras e para o desenvolvimento de novas terapias.
Nas séries de TV sobre hospitais, os médicos buscam diagnósticos corretos e possíveis tratamentos para pacientes com sintomas às vezes intrigantes ou estranhos. Na realidade, este processo demora frequentemente anos para as pessoas afetadas por doenças raras. Em muitos casos, não existe medicação eficaz e as opções terapêuticas são limitadas.
Aproximadamente 6%–8% da população mundial sofre de uma doença rara. Isto representa cerca de 500 milhões de pessoas, embora cada uma das mais de 7.000 doenças diferentes afecte apenas cerca de 1 em 2.000 pessoas. Dado que estas doenças são tão raras, o conhecimento médico e científico sobre elas é limitado. Existem apenas alguns especialistas em todo o mundo e falta consciência social.
Desvendando a estrutura e função das proteínas para compreender doenças e desenvolver terapias
Uma equipe internacional de pesquisadores liderada por Schara Safarian, líder do grupo de projeto do Instituto Max Planck de Biofísica, bem como líder do grupo independente do Instituto Fraunhofer de Medicina Translacional e Farmacologia ITMP, e do Instituto de Farmacologia Clínica da Universidade Goethe de Frankfurt, agora investigaram a estrutura e a função celular de duas proteínas, FLVCR1 e FLVCR2, que desempenham um papel causal em uma série de doenças hereditárias raras.
Os cientistas publicaram suas descobertas na Nature .
O mau funcionamento de FLVCR1 e FLVCR2 devido a mutações genéticas causa doenças raras, algumas das quais resultam em distúrbios visuais, de mobilidade e sensoriais graves, como ataxia da coluna posterior com retinite pigmentosa, síndrome de Fowler ou neuropatias sensoriais e autonômicas. Este último pode, por exemplo, levar à perda total da sensação de dor.
“Em muitas doenças, inclusive nas raras, as estruturas celulares do nosso corpo são alteradas e isso leva a disfunções nos processos bioquímicos”, diz Schara Safarian. “Para compreender o desenvolvimento de tais doenças e desenvolver terapias, precisamos de saber como estas proteínas estão estruturadas a nível molecular e quais as funções que desempenham nas células saudáveis”.
FLVCR1 e FLVCR2 transportam os blocos de construção celular colina e etanolamina
Os cientistas descobriram que o FLVCR 1 e o FLVCR2 transportam as moléculas colina e etanolamina através das membranas das nossas células. “A colina e a etanolamina são essenciais para funções corporais importantes. Apoiam o crescimento, a regeneração e a estabilidade das nossas células, por exemplo nos músculos, órgãos internos e no cérebro”, explica Safarian.
“Além disso, a colina está envolvida no metabolismo da gordura e na desintoxicação pelo fígado. Nosso corpo também precisa dela para produzir o neurotransmissor acetilcolina, que é crucial para o nosso sistema nervoso e é necessário ao nosso cérebro para controlar os órgãos. das proteínas FLVCR podem causar distúrbios neurológicos e musculares graves."
Os pesquisadores usaram métodos microscópicos, bioquímicos e assistidos por computador para investigar as proteínas FLVCR. “Congelamos as proteínas por choque e depois as observamos sob um microscópio eletrônico”, explica Di Wu, pesquisador do Instituto Max Planck de Biofísica e coautor do estudo. "Um feixe de elétrons penetra na amostra congelada e a interação dos elétrons com o material cria uma imagem."
Os pesquisadores pegam muitas imagens individuais e as processam e as combinam computacionalmente para obter estruturas de proteínas 3D de alta resolução. Dessa forma, eles conseguiram decifrar as estruturas do FLVCR1 e do FLVCR2 e ver como elas mudam na presença de etanolamina e colina. Simulações de computador confirmaram e visualizaram como as proteínas FLVCR interagem com a etanolamina e a colina e alteram dinamicamente sua estrutura para permitir o transporte de nutrientes.
Safarian resume:"Nossas descobertas abrem caminho para a compreensão do desenvolvimento e progressão de doenças raras associadas às proteínas FLVCR. No futuro, os pacientes poderão se beneficiar de novas terapias que restaurem sua qualidade de vida".
