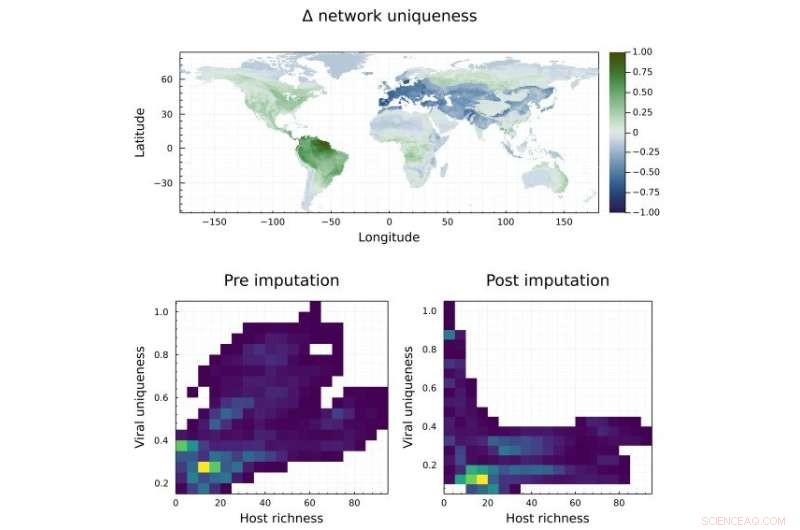
A rede imputada revela hotspots não descobertos de associações exclusivas de vírus de host na Amazônia. Acima:Diferença entre a singularidade de composição (variada) da comunidade viral com base na presença do hospedeiro (ver ED Fig. 7). As áreas verdes escuras indicam que a rede imputada sugere uma maior originalidade da comunidade viral do que os dados disponíveis. Abaixo:comparação entre o número de hosts e a singularidade da comunidade viral. Assumindo a descoberta aleatória de vírus por amostragem de hospedeiros, essa relação seria globalmente linear e positiva, como é o caso da pré-imputação. A adição de interações imputadas remove alguns dos vieses de amostragem e mostra como áreas com menor riqueza de hospedeiros têm contribuições mais exclusivas para a singularidade viral, o que sugere que elas abrigam vírus não compartilhados por locais mais específicos. Crédito:arXiv:2105.14973v2 [q-bio.QM], https://arxiv.org/abs/2105.14973
Até recentemente, conhecíamos apenas dois por cento das possíveis interações entre mamíferos e vírus, ou o "viroma". No entanto, uma nova técnica de inteligência artificial (IA) identificou potenciais novas interações vírus-hospedeiro, aumentando o tamanho do vírus conhecido por um fator de 15.
Uma nova abordagem baseada em aprendizado de máquina para prever interações vírus-hospedeiro foi aplicada e 35.000 horas de computador foram usadas nos computadores da Calcul Québec para analisar dados sobre interações entre mil mamíferos (os hospedeiros) e tantos vírus.
Após a identificação de 80.000 novas interações vírus-hospedeiro em potencial, a rede de associações vírus-hospedeiro foi emparelhada com um modelo de genoma de vírus para reavaliar o potencial de infecção humana de todos os vírus no banco de dados.
O resultado foi uma lista de vírus animais que poderiam causar zoonoses, ou seja, infectar humanos.
O projeto de pesquisa internacional colaborativa foi liderado por Timothée Poisot, professor do Departamento de Ciências Biológicas da Universidade de Montreal interessado em calcular riscos pandêmicos. Foi financiado pelo IVADO, o Institute for Data Valorization, e realizado como parte da Viral Emergence Research Initiative.
Descobrindo vírus 'esquecidos' Para validar suas previsões, Poisot e sua equipe de especialistas em virologia, IA e saúde pública pesquisaram a literatura sobre surtos humanos anteriores dos vírus que eles classificaram como de alto risco. Descobriu-se que dos 20 vírus com maior potencial zoonótico, 11 de fato deixaram os humanos doentes.
"Alguns dos vírus realmente nos surpreenderam; não achávamos que pudessem ser transmitidos aos humanos", disse Poisot. "Por exemplo, nosso sistema calculou que a ectromelia, o vírus responsável pela varíola em camundongos, tem uma probabilidade 'muito alta' de infectar humanos, e descobrimos que realmente houve um surto em uma escola chinesa em 1987, mas não foi listado. em qualquer um dos bancos de dados."
No geral, as famílias de vírus que aparecem com mais frequência na lista de alto risco são os bunyavírus (um dos quais causa a febre do Vale do Rift), rabdovírus (raiva), filovírus (Ebola) e flavivírus (dengue, febre amarela). "Estas são todas as famílias que são conhecidas por apresentarem risco zoonótico significativo, mas o modelo pode nos permitir medir o risco dentro dessas famílias com mais precisão", explicou Poisot.
Monitoramento de hotspots, principalmente a Amazônia Essa pesquisa preditiva pode ajudar a orientar os esforços dos virologistas que trabalham para prevenir zoonoses que podem causar futuras epidemias e pandemias. A lista de vírus de alto risco pode ser usada para direcionar campanhas de amostragem em espécies específicas e também com base na distribuição geográfica, pois a equipe de pesquisa mapeou os resultados.
“Como ecologista fazendo pesquisa biogeográfica, quero saber não apenas qual vírus será compatível com qual hospedeiro, mas também onde essas combinações podem ser encontradas”, disse Poisot.
De acordo com o modelo computacional, a Amazônia é a parte do mundo com maior potencial para mutações virais. "Os resultados são claros:a Amazônia é um ponto de acesso para novas interações vírus-hospedeiro", disse Poisot. "É a região onde encontramos a maioria das interações que normalmente não ocorrem."
Segundo Poisot, esses novos contatos podem ser explicados pela falta de dados sobre o vírus amazônico, desmatamento, mudanças climáticas e expansão urbana, o que aumenta o contato entre animais e humanos.
