Resumo gráfico. Crédito:Célula Molecular (2022). DOI:10.1016/j.molcel.2022.06.024
Publicado na
Célula Molecular Em 19 de julho, um estudo de pesquisa do Hatters Laboratory mostrou que a agregação inadequada de proteínas está ligada a resultados ruins para a saúde e a sobrevivência das células – especialmente em neurônios em doenças neurodegenerativas.
O estudo investigou as forças motrizes moleculares que fazem com que as proteínas mal dobradas se unam anormalmente e analisou o impacto das proteínas pegajosas nas proteínas circundantes em uma célula, especificamente como os sistemas de proteostase detectam essas proteínas pegajosas para evitar que se agreguem.
A pesquisa é resultado de uma colaboração entre o professor Rohit Pappu da Universidade de Washington, pesquisadores da Universidade de Melbourne, incluindo Ph.D. estudante e primeiro autor igual, Yoon Hee Choi, Professor David Ascher, Dr. Dezerae Cox e Angelique Haynes e pesquisadores da Universidade de Leeds.
"Descobrimos que havia proteínas específicas que normalmente regulam o dobramento de proteínas - chamadas chaperonas moleculares - que são muito específicas para detectar padrões de adesivos específicos. Esta é uma descoberta importante, pois informa como as células detectam quando as proteínas estão se agregando anormalmente", disse o professor Hatters.
As proteínas são fundamentais para o funcionamento das células e a sobrevivência e proliferação celular requer que as proteínas se dobrem e se liguem a outras proteínas.
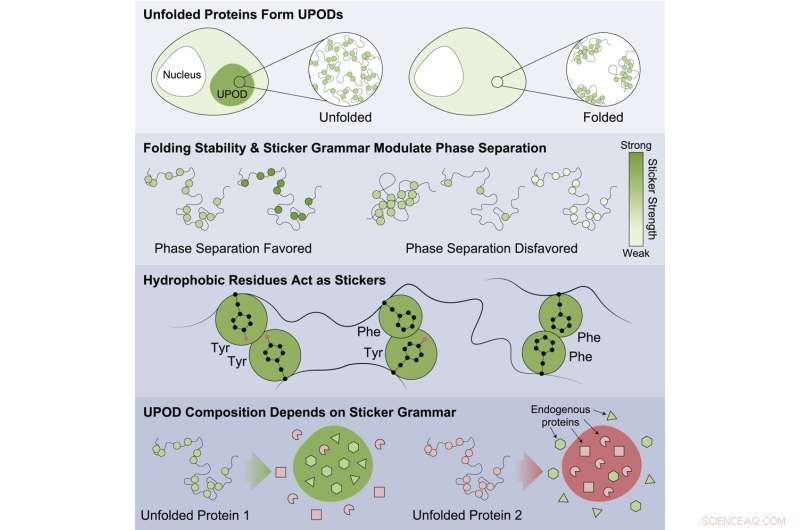
"Quando as proteínas não se dobram adequadamente, formas intermediárias 'mal dobradas' - conhecidas como depósitos de proteínas não dobradas (UPODs) - podem se unir em agregados. ' quebrar", disse Choi.
O estudo destacou que as proteínas menos estáveis eram mais propensas a agregar e serem associadas a doenças. Os resultados sugerem que isso é feito através da agregação inadequada de formulários mal dobrados com diferentes subunidades que detectam diferentes códigos de "adesivo" que direcionam a agregação. As proteínas estão envolvidas em um grande número de doenças, incluindo câncer, distúrbios congênitos, doenças do sistema nervoso, distúrbios do metabolismo e doenças da pele.
Padrões específicos de adesivos foram encontrados que eram importantes para a agregação direta e que faziam com que outras proteínas circunvizinhas na célula fossem co-agregadas. O trabalho mostrou que certas classes de aminoácidos eram os melhores adesivos - tirosina e fenilalanina - e que o padrão dos aminoácidos era importante para a forma como as proteínas espectadoras eram inadequadamente coagregadas e como as chaperonas moleculares reconheciam os agregados que se formavam.
"O próximo passo é entender melhor os mecanismos disso. Isso pode ser útil em esforços futuros para reprogramar células para melhor limpar agregados de proteínas, como em doenças onde eles se acumulam extensivamente", disse o professor Hatters.
