Um novo gene em mamíferos que controla uma nova estrutura encontrada nas células nervosas
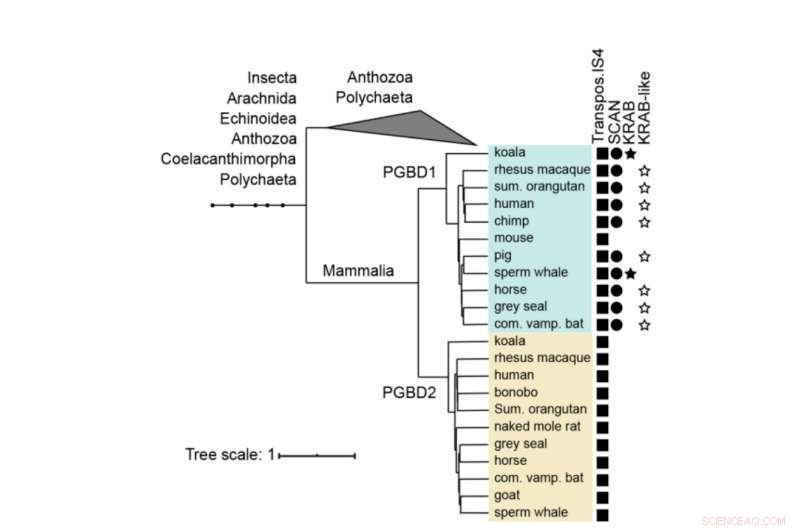
Árvore filogenética de PGBD1 e PGBD2. A presença dos domínios derivados da transposase, SCAN e KRAB são mostrados. Os PGBD1 e PGBD2 humanos, com as sequências mais intimamente relacionadas (contendo a transposase IS4) foram alinhados com o músculo e uma árvore foi construída usando MrBayes. Os domínios de proteína foram anotados com hmmerscan e CDD (NCBI). O domínio KRAB foi anotado com Phyre2. Crédito:Biologia Molecular e Evolução (2022). DOI:10.1093/molbev/msac175
A evolução é muitas vezes retratada como um processo de "conserto", que faz uso de pequenas modificações nas capacidades pré-existentes. Então, como os organismos desenvolvem novas estruturas?
Um novo estudo da Dra. Zsuzsanna Izsvák do Max Delbrück Center for Molecular Medicine na Helmholtz Association (Max Delbrück Center) e do professor Laurence Hurst do Milner Center for Evolution da University of Bath (Reino Unido) encontrou evidências de que a evolução de um novo gene sustenta a evolução de uma nova estrutura encontrada nas células nervosas. Eles descrevem esse gene incomum chamado piggyBac Transposable Element-derived 1, ou PGBD1, na revista
Molecular Biology and Evolution .
Os 'genes saltadores' causam mutações O PGBD1 é um dos cinco genes PGBD relacionados que mostra uma semelhança distinta com o elemento piggyBac identificado pela primeira vez em insetos - daí o nome derivado do Elemento Transponível piggyBac. Os elementos PiggyBac são "genes saltadores", também chamados de transposons. Eles são capazes de se copiar e se mover de um local para outro no genoma, às vezes introduzindo mutações ou alterando funções. Os transposons PiggyBac chegaram à nossa espécie por transferência horizontal – semelhante à forma como alguns vírus podem integrar seu genoma em nosso DNA.
No entanto, enquanto os transposons piggyBac perderam sua capacidade de pular em nosso DNA ao longo do tempo, cinco genes derivados de elementos transponíveis piggyBac (PGBD1-5) foram corrigidos em humanos. "Nosso objetivo era descobrir qual função potencialmente útil os genes PGBD podem ter", diz Zsuzsanna Izsvák. "Para este estudo, nos concentramos no PGBD1."
Entre os cinco genes PGBD, o PGBD1 é o único que também incorporou partes de outros genes, resultando em uma proteína que possui partes extras capazes de se ligar a outras proteínas e ao DNA. PGBD1 é, portanto, um novo gene que é parte do fragmento do gene humano, parte do gene de salto inativo.
PGBD1 regula as células nervosas e suas 'armadilhas de proteína' PGBD1 é encontrado apenas em mamíferos. É particularmente ativo em células que se tornam neurônios. Os pesquisadores investigaram pela primeira vez onde a proteína PGBD1 se liga ao DNA, observando que ela se cola dentro e ao redor dos genes associados ao desenvolvimento do nervo. Eles descobriram que o PGBD1 controla o desenvolvimento de células nervosas bloqueando genes expressos em células nervosas maduras, mantendo os genes associados a serem células pré-nervosas ativadas. A redução do nível de PGBD1 nas células pré-nervosas fez com que elas começassem a se desenvolver como células nervosas.
Um dos genes que a proteína PGBD1 se liga atraiu especialmente seu interesse. NEAT1 é um gene estranho que codifica um RNA que, incomumente, não produz uma proteína. Em vez disso, esse produto, um RNA não codificador, faz a espinha dorsal de uma estrutura física, os paraspeckles. Essas são estruturas minúsculas nos núcleos de algumas de nossas células que agem como armadilhas para alguns RNAs e proteínas.
Os pesquisadores descobriram que, em células pré-nervosas, a proteína PGBD1 se liga ao gene NEAT1 e o impede de funcionar. No entanto, quando os níveis de PGBD1 diminuem, os níveis de RNA NEAT1 aumentam, formam-se paraspeckles e as células tornam-se células nervosas maduras. PGBD1, portanto, evoluiu para ser um regulador chave da presença ou ausência de paraspeckles e, portanto, o regulador do desenvolvimento de células nervosas.
Evolução não é ajustes aleatórios O que, no entanto, é mais intrigante é que os paraspeckles são, como o PGBD1, também específicos de mamíferos. O PGBD1 é então um exemplo raro de um novo gene que evoluiu para regular uma nova estrutura, ainda que pequena. Zsuzsanna Izsvák, coautora sênior do Max Delbrück Center, diz:"Esta é uma descoberta realmente incomum e inesperada. mais do que apenas mexer. Este é um novo gene para controlar uma nova estrutura." A questão excitante agora é se ele também desempenha um papel nos neurônios adultos.
O co-autor sênior, professor Laurence Hurst, do Milner Center for Evolution da Universidade de Bath, acrescenta que eles "descobriram como os paraspeckles são controlados, agora só precisamos descobrir como o próprio paraspeckle evoluiu. Isso pode ser uma tarefa muito mais difícil. como RNAs não codificantes como NEAT1 tendem a evoluir rapidamente e, portanto, difíceis de rastrear ao longo do tempo evolutivo."
Este acoplamento entre NEAT1 e PGBD1 também pode estar envolvido na esquizofrenia. Embora o NEAT1 tenha sido anteriormente associado a essa doença neurológica, a equipe identificou algumas mutações no PGBD1 que poderiam mostrar que também eram comuns em pacientes com esquizofrenia – uma dessas mutações altera a proteína do PGBD1, enquanto outras podem controlar seu nível.
O primeiro autor Dr. Tamas Raskó, na época do estudo um pesquisador de pós-doutorado no grupo de Zsuzsanna Izsvák diz que "certamente é mais do que coincidência que ambos os genes estejam envolvidos na esquizofrenia. É muito incomum encontrar uma mutação que altere um proteína que está acoplada a esta doença. Os efeitos desta mutação devem ser uma prioridade para novos estudos."
+ Explorar mais Cientistas desvendam o mistério dos genes que são a chave para o desenvolvimento do cérebro
