A vida dupla do Sp1:um novo papel das proteínas derruba o pensamento sobre seu impacto no câncer
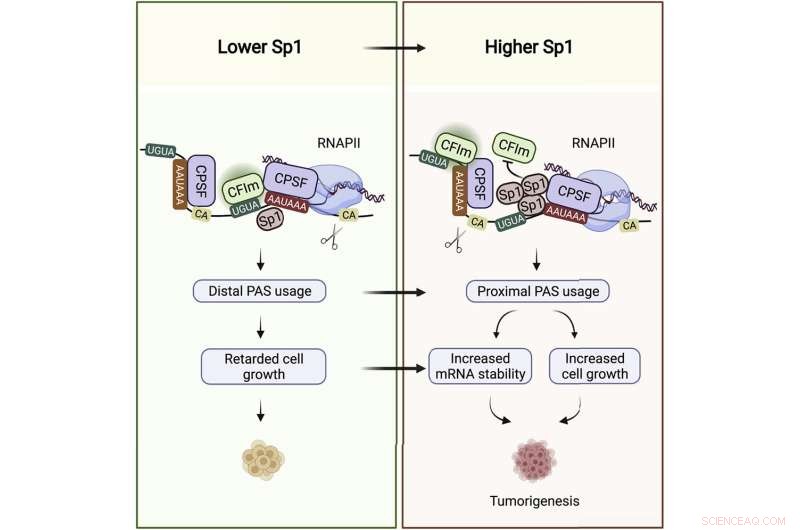
Resumo gráfico. Crédito:Célula Molecular (2022). DOI:10.1016/j.molcel.2022.06.031
Por quatro décadas, a proteína de especificidade 1 (Sp1) foi lançada apenas como um fator de transcrição, um tipo de proteína que se liga ao DNA e ativa os genes. Mas um estudo do Donnelly Center revelou agora que Sp1 desempenha outro papel inesperado na regulação do gene, influenciando a estabilidade das mensagens de RNA dos genes.
A descoberta é especialmente significativa para a pesquisa do câncer, pois derruba o pensamento estabelecido sobre como o Sp1 contribui para a doença e abre novos caminhos para o desenvolvimento do tratamento.
"Sabe-se que o Sp1 está envolvido no câncer há muito tempo, mas pensava-se que era por causa de sua capacidade de se ligar ao DNA e agir como um fator de transcrição, porque todos sabiam disso", disse Jack Greenblatt, autor sênior do estudo. papel e professor de genética molecular no Donnelly Center for Cellular and Biomolecular Research, na U of T's Temerty Faculty of Medicine.
"Achamos que essa não é a resposta. Achamos que isso afeta o câncer por meio de sua capacidade de se ligar ao RNA e regular a estabilidade da transcrição", disse Greenblatt, que também é professor universitário.
A revista
Célula Molecular publicou as descobertas.
A pesquisa lança uma nova luz inesperada sobre uma das proteínas humanas mais estudadas. Sp1 foi identificado pela primeira vez como um ativador transcricional de ligação ao DNA há quase 40 anos e foi o primeiro regulador transcricional humano a ser purificado, disse Greenblatt. "É um tópico padrão em livros didáticos de graduação", acrescentou.
Sp1 controla a ativação de cerca de 6.000 genes - aproximadamente um terço do genoma humano - que são principalmente necessários para o sustento celular.
E agora há também o Sp1 de ligação ao RNA, que domina outro grupo de 2.000 genes, principalmente não sobrepostos, impactando a abundância de suas cópias de mRNA, de acordo com o estudo.
Quando um gene é ativado, seu código é copiado em um RNA mensageiro, ou uma transcrição, que serve como modelo para a construção da molécula de proteína codificada. Em sua extremidade caudal, o mRNA abriga a região não traduzida, ou UTR, que não é traduzida em proteína, mas que tem um papel regulador e é importante para a estabilidade da transcrição. A pesquisa mostrou que os transcritos com caudas UTR longas são frequentemente menos estáveis e são degradados mais rapidamente pelas enzimas celulares, enquanto os UTRs de cauda curta são mais protegidos da degradação.
"É aqui, no UTR, que Sp1 liga seus mRNAs alvo", disse Syed Nabeel-Shah, Ph.D. candidato no laboratório e co-primeiro autor da pesquisa, juntamente com o ex-bolsista de pós-doutorado do laboratório Greenblatt, Jingwen Song. Quando Nabeel-Shah e Song esgotaram Sp1 das células, eles descobriram que isso levou a um aumento no comprimento UTR de certas transcrições, indicando que Sp1 atua para produzir caudas UTR mais curtas. Eles mostraram ainda que o corte UTR é realizado pela maquinaria de clivagem de RNA, que corta o RNA perto de onde Sp1 está ligado.
O controle do comprimento da UTR emergiu como uma importante camada de regulação gênica. Isso é especialmente verdadeiro em células cancerosas, que abundam em transcrições de cauda curta. Quanto mais curta a cauda UTR, mais estável é o mRNA para muitos transcritos, o que significa mais modelos de proteína – e, finalmente, mais moléculas de proteína que podem ser produzidas.
"As células de crescimento rápido precisam de certos genes expressos em níveis mais altos", disse Greenblatt. "O efeito de ter UTRs mais curtas é muitas vezes uma maior concentração de mRNA e, consequentemente, maior concentração de proteína".
Ainda não está claro, no entanto, como o equilíbrio é desviado para UTRs mais curtos em células cancerígenas. Mas Greenblatt e Nabeel-Shah acham que Sp1 tem parte da chave.
Há muito se sabe que os níveis de Sp1 são elevados em muitos tipos de câncer, incluindo câncer de mama, no qual Nabeel-Shah e Song focaram sua análise. Eles obtiveram dados de sequenciamento de RNA do Atlas do Genoma do Câncer em mil pacientes com câncer de mama. Eles descobriram que os níveis de Sp1 se correlacionam com o comprimento e a abundância da cauda da transcrição alvo. Quanto mais Sp1 em uma amostra de paciente, mais curtos serão os UTRs na mesma amostra e mais altos serão os níveis de mRNA quando esses UTRs estiverem ligados por Sp1. "Tudo isso sugere que Sp1 promove o câncer através de seu papel de ligação ao RNA", disse Nabeel-Shah.
A descoberta contrasta com a visão estabelecida de que Sp1 contribui para o câncer ao turbinar a expressão de seus genes-alvo como uma proteína de ligação ao DNA. Nabeel-Shah e Song não encontraram suporte nos dados para este conceito. Não houve correlação significativa entre os níveis de Sp1 em células de câncer de mama e a quantidade de mRNA transcrito dos genes que visa no DNA.
Embora tenham analisado apenas o câncer de mama, os pesquisadores acreditam que o Sp1 desempenha um papel semelhante em outros tipos de câncer, dado o grande número de mRNAs que regula.
O estudo abre uma nova maneira de pensar não apenas sobre Sp1 e seu papel no câncer, mas também sobre outras proteínas semelhantes. Sp1 pertence a uma família de fatores de transcrição de dedo de zinco C2H2, que formam o maior grupo de fatores de transcrição em humanos. A maioria de seus mais de 700 membros permanece pouco explorada, no entanto.
O objetivo da tese de Nabeel-Shah é determinar se muitas outras proteínas C2H2 também se ligam ao RNA. Até agora, ele testou 150 dessas proteínas e descobriu que 145 se ligam tanto ao DNA quanto ao RNA, sugerindo que muitos outros membros também podem ter papéis duplos na regulação dos genes.
Sp1 foi apenas o primeiro a ser descoberto, assim como há quatro décadas.
+ Explorar mais Mecanismo de expressão gênica pode ter imunidade, implicações de câncer
