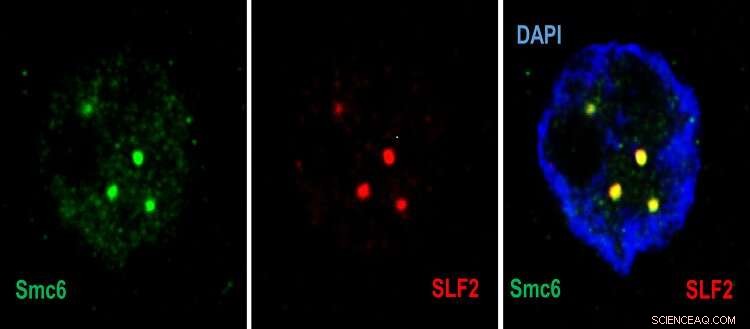
Imagens de microscopia confocal mostrando no núcleo da célula (azul), o recrutamento de Smc5/6 (verde) por SLF2 (vermelho) em corpos de PML. Crédito:© UNIGE–Laboratório do Professor Michel Strubin–Regulação da expressão gênica do vírus da hepatite B–Departamento de Microbiologia e Medicina Molecular.
O vírus da hepatite B (HBV) é responsável por uma das doenças infecciosas mais graves e comuns. Transmitido através de fluidos biológicos, ataca as células do fígado. A forma crônica da doença pode levar a complicações graves, incluindo cirrose e câncer de fígado. Não existe tratamento eficaz para a forma crônica da doença, que só pode ser prevenida com vacinação. Após identificar um complexo proteico chave que está ativo quando nosso corpo é infectado pelo vírus, uma equipe da Universidade de Genebra (UNIGE) decifrou o funcionamento preciso desse mecanismo protetor, abrindo caminho para novos alvos terapêuticos. Estes resultados podem ser lidos na revista
Nature Structural &Molecular Biology .
A hepatite B é a forma mais comum de hepatite. É uma doença viral causada pelo vírus da hepatite B. É principalmente transmitido sexualmente ou transferido através do sangue. É até 100 vezes mais contagioso que o HIV. Ao infectar as células do fígado, esse vírus causa uma inflamação transitória desse órgão que também pode evoluir para uma infecção crônica. Isso pode levar a patologias graves, como cirrose ou câncer de fígado. Estima-se que cerca de 1 milhão de pessoas morrem a cada ano desta doença em todo o mundo. Não há tratamento definitivo para a hepatite B crônica. A única forma de prevenção é vacinar-se antes que a doença apareça.
Em 2016, uma equipe da UNIGE liderada por Michel Strubin, professor associado do Departamento de Microbiologia e Medicina Molecular e do Centro de Pesquisa em Inflamação de Genebra da Faculdade de Medicina da UNIGE, revelou um mecanismo crucial para entender essa doença:quando nosso o sistema imunológico se defende contra ele, um complexo – um conjunto interdependente – de seis proteínas chamadas SMC5/6, presentes em nossas células, detecta o DNA viral e o bloqueia. O vírus então contra-ataca e produz uma proteína específica, a proteína X. Essa proteína entra na célula e degrada SMC5/6, que não é mais capaz de desempenhar seu papel de sentinela.
Um mecanismo de três etapas Antes desta descoberta, a função antiviral do SMC5/6 era desconhecida. Foi identificado apenas como um complexo chave para a manutenção estrutural de nossos cromossomos. Hoje, a equipe de Michel Strubin fez um novo avanço. Em um estudo recente, realizado em colaboração com a empresa farmacêutica americana Gilead Sciences, os pesquisadores da UNIGE identificaram as três etapas e as proteínas específicas necessárias para que o SMC5/6 desempenhe seu papel antiviral.
"No primeiro passo, uma proteína do complexo SMC5/6 detecta o DNA do vírus e o prende", explica Fabien Abdul, pesquisador sênior e assistente de ensino do Departamento de Microbiologia e Medicina Molecular da Faculdade de Medicina da UNIGE e primeiro autor do estudo. "Então, uma segunda proteína do complexo - SLF2 - leva o DNA aprisionado do vírus para um subcompartimento do núcleo da célula atacada, chamado de corpo PML. Uma terceira proteína - Nse2 - então entra em ação e inibe a cromossomo do vírus”.
Como o SMC é uma grande família de complexos proteicos, os pesquisadores também queriam saber se outros membros dessa família eram capazes de se ligar ao DNA viral da hepatite B. "Descobrimos que essa competência era exclusiva do SMC5/6", diz Fabien Abdul.
Em direção a novos alvos terapêuticos Para alcançar esses resultados, a equipe de pesquisa trabalhou em culturas de células in vitro. "Usamos técnicas de biologia molecular e mais especificamente tesoura genética chamada CRISPR-Cas9. Essa ferramenta nos permitiu cortar as fitas de DNA dentro das células e, assim, excluir ou modificar o gene codificador de cada proteína que constitui o complexo SMC5/6. Graças a essa técnica , conseguimos fazer uma ou outra das proteínas desaparecer e assim entender suas respectivas funções dentro do complexo", explica Michel Strubin, último autor do estudo. Com base nessas observações, as três etapas do mecanismo antiviral puderam ser estabelecidas.
Essa descoberta fornece uma melhor compreensão de como o complexo funciona durante sua ação antiviral. Poderia, assim, abrir caminho para a identificação de novos alvos terapêuticos para combater o vírus da hepatite B. "A próxima etapa da pesquisa consistirá em decifrar melhor o mecanismo de inibição do vírus no subcompartimento do núcleo da célula", indica Aurélie Diman, pesquisadora de pós-doutorado no laboratório de Michel Strubin. Também será preciso trabalhar a proteína X, cujo papel foi identificado pelos pesquisadores da UNIGE em 2016, para melhor compreender o mecanismo de contra-ataque da hepatite B contra a atividade antiviral do SMC5/6 celular.
+ Explorar mais Contra-ataque do vírus da hepatite B
