Nova força de superfície intermolecular revela mecanismo de condução da actomiosina
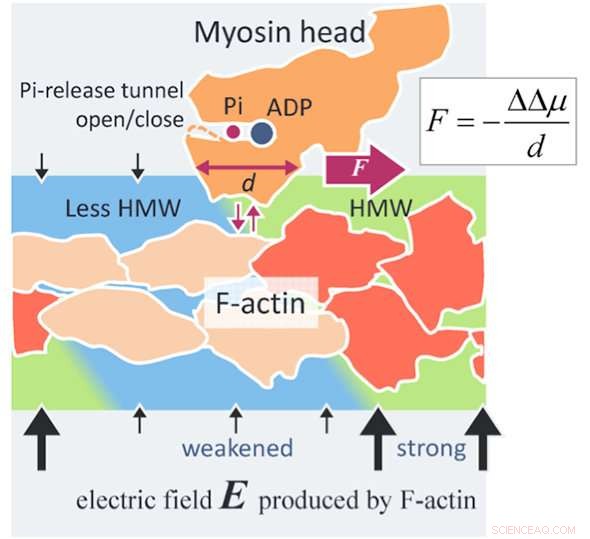 p Um novo mecanismo de geração de força de actomiosina. Um filamento de actina (F-actina) produz um campo elétrico (setas pretas) tão alto quanto 100 MV / m em torno de F-actina devido às suas cargas superficiais negativas. As moléculas de água em um campo elétrico tão alto tornam-se moléculas de água hipermóveis (HMW, verde claro) nas proximidades da F-actina. Por outro lado, O ATP em solução se liga a uma cabeça de miosina (laranja) e é dividido em difosfato de adenosina (ADP) e fosfato inorgânico (Pi) na cabeça. Quando a cabeça de miosina com ADP e Pi se liga à F-actina (vermelho alaranjado), várias subunidades de actina mudam suas estruturas (bege). Em seguida, a intensidade do campo elétrico diminui em torno dessas subunidades de actina alteradas e a intensidade HMW também diminui (azul claro) para se tornar perto da água livre. No presente estudo, o estado de hidratação da proteína foi considerado mais estável na região HMW mais forte. Na figura, a cabeça da miosina é dirigida para a direita, onde a intensidade HMW é mais forte (verde claro), com descolamento da F-actina e ligando novamente com F-actina. A força avaliada pelo presente método é tão alta quanto vários piconewtons, que está ao nível dos valores experimentais. Este pode ser um princípio de nova força de superfície agindo entre uma macromolécula carregada, como proteína e DNA, e uma proteína soluto amplamente aplicável à ciência e tecnologia. Crédito:Makoto Suzuki
p Um novo mecanismo de geração de força de actomiosina. Um filamento de actina (F-actina) produz um campo elétrico (setas pretas) tão alto quanto 100 MV / m em torno de F-actina devido às suas cargas superficiais negativas. As moléculas de água em um campo elétrico tão alto tornam-se moléculas de água hipermóveis (HMW, verde claro) nas proximidades da F-actina. Por outro lado, O ATP em solução se liga a uma cabeça de miosina (laranja) e é dividido em difosfato de adenosina (ADP) e fosfato inorgânico (Pi) na cabeça. Quando a cabeça de miosina com ADP e Pi se liga à F-actina (vermelho alaranjado), várias subunidades de actina mudam suas estruturas (bege). Em seguida, a intensidade do campo elétrico diminui em torno dessas subunidades de actina alteradas e a intensidade HMW também diminui (azul claro) para se tornar perto da água livre. No presente estudo, o estado de hidratação da proteína foi considerado mais estável na região HMW mais forte. Na figura, a cabeça da miosina é dirigida para a direita, onde a intensidade HMW é mais forte (verde claro), com descolamento da F-actina e ligando novamente com F-actina. A força avaliada pelo presente método é tão alta quanto vários piconewtons, que está ao nível dos valores experimentais. Este pode ser um princípio de nova força de superfície agindo entre uma macromolécula carregada, como proteína e DNA, e uma proteína soluto amplamente aplicável à ciência e tecnologia. Crédito:Makoto Suzuki
p O complexo de actina e miosina (actomiosina) gera força de contração de um músculo utilizando a reação de hidrólise do trifosfato de adenosina (ATP). Muitas tentativas têm sido feitas para explicar a origem molecular da motilidade da actomiosina. p Um modelo de golpe de poder de miosina, proposto por Huxley e Simmons em 1971, iniciou muitas pesquisas, incluindo estudos da estrutura atômica e a investigação da biologia molecular das moléculas de miosina e actina. O modelo de golpe de poder, modificado recentemente, é amplamente adotado em livros-texto de biologia padrão.
p Contudo, permanece um problema sério. De acordo com os dados experimentais da termodinâmica, a hidrólise do ATP na cabeça da miosina não produz um estado de miosina com energia alta o suficiente para gerar a força de contração.
p Agora, um grupo de pesquisa, liderado pelo Professor Emérito Makoto Suzuki na Tohoku University em colaboração com o Professor Nobuyuki Matubayasi na Osaka University, conseguiu explicar o mecanismo de condução da actomiosina de acordo com os dados experimentais da termodinâmica.
p No estudo, a estrutura da água em estreita proximidade de um filamento de actina (F-actina) é modificada após a ligação com uma cabeça de miosina hidrolisando ATP para F-actina, isso leva a uma mudança na afinidade com a cabeça da miosina e, portanto, à geração da força motriz da actomiosina.
p A presença da nova força de superfície intermolecular - que foi demonstrada pela primeira vez com base nas análises de hidratação atuais - foi uma descoberta marcante. Este artigo é, Portanto, o primeiro a desvendar com sucesso o mecanismo de condução da actomiosina, introduzindo uma nova força de superfície intermolecular.
