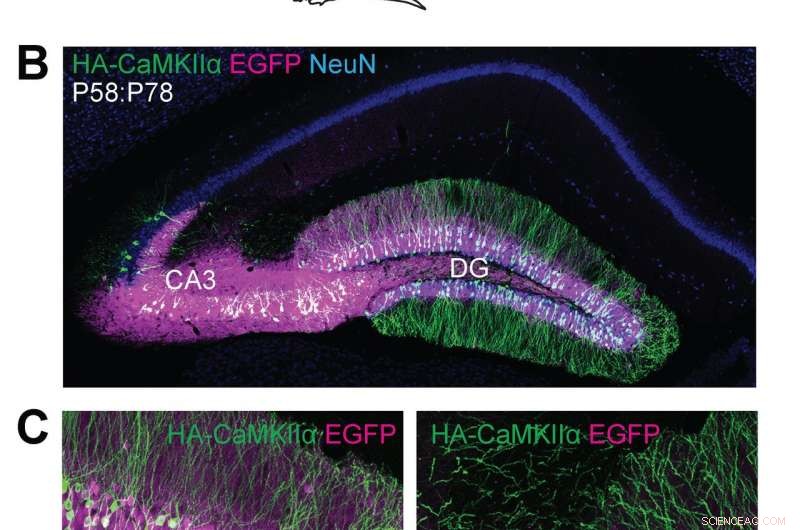
 p (A) Ilustrações esquemáticas de experimentos. (B, C) Imagens microscópicas confocais de seções cerebrais coronais do hipocampo de camundongos Cas9, mostrando a fluorescência EGFP (B, C, magenta), imunorreatividades para NeuN (B, azul) e a tag HA (B, C, verde) fundido ao terminal N de CaMKIIα endógeno. Crédito:Max Planck Florida Institute for Neuroscience
p (A) Ilustrações esquemáticas de experimentos. (B, C) Imagens microscópicas confocais de seções cerebrais coronais do hipocampo de camundongos Cas9, mostrando a fluorescência EGFP (B, C, magenta), imunorreatividades para NeuN (B, azul) e a tag HA (B, C, verde) fundido ao terminal N de CaMKIIα endógeno. Crédito:Max Planck Florida Institute for Neuroscience
p As tecnologias de edição de genoma revolucionaram a ciência biomédica, fornecendo uma maneira rápida e fácil de modificar genes. Contudo, a técnica que permite aos cientistas realizar as edições mais precisas, não funciona em células que não estão mais se dividindo - o que inclui a maioria dos neurônios do cérebro. Essa tecnologia tinha uso limitado na pesquisa do cérebro, até agora. Pesquisador Jun Nishiyama, M.D., Ph.D., Pesquisa científica, Takayasu Mikuni, M.D., Ph.D., e Diretor Científico, Ryohei Yasuda, Ph.D. no Max Planck Florida Institute for Neuroscience (MPFI) desenvolveram uma nova ferramenta que, pela primeira vez, permite a edição precisa do genoma em neurônios maduros, abrindo novas possibilidades na pesquisa em neurociência. p Esta nova e poderosa ferramenta utiliza a tecnologia de edição de genes recém-descoberta do CRISPR-Cas9, um mecanismo de defesa viral originalmente encontrado em bactérias. Quando colocado dentro de uma célula, como um neurônio, o sistema CRISPR-Cas9 atua danificando o DNA em um local especificamente direcionado. A célula, então, repara subsequentemente esse dano usando predominantemente dois métodos opostos; sendo uma união de extremidade não homóloga (NHEJ), que tende a ser sujeito a erros, e reparo dirigido por homologia (HDR), que é muito preciso e capaz de sofrer inserções de genes específicos. HDR é o método mais desejado, permitindo aos pesquisadores flexibilidade para adicionar, modificar, ou deletar genes dependendo da finalidade pretendida.
p Persuadir as células cerebrais a fazer uso preferencial do mecanismo de reparo do DNA de HDR tem sido um grande desafio. HDR foi originalmente pensado para estar disponível apenas como uma rota de reparo para células em proliferação ativa no corpo. Quando as células cerebrais precursoras amadurecem em neurônios, eles são referidos como células pós-mitóticas ou que não se dividem, tornando o cérebro maduro em grande parte inacessível ao HDR - ou assim os pesquisadores pensavam anteriormente. A equipe agora mostrou que é possível para os neurônios pós-mitóticos do cérebro se submeterem ativamente a HDR, denominando a estratégia "vSLENDR (marcação de célula única mediada por vírus de proteínas endógenas por CRISPR-Cas9 mediada por reparo direcionado por homologia)." A chave crítica para o sucesso desse processo é o uso combinado de CRISPR-Cas9 e um vírus.
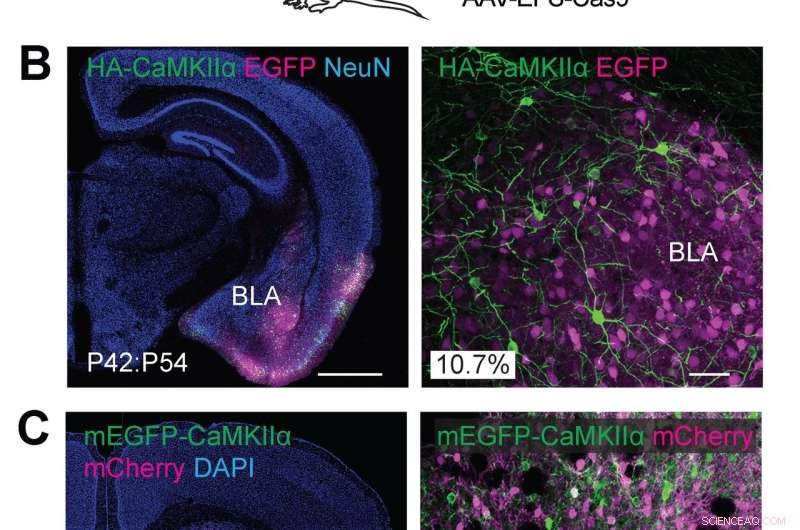 p (A) Ilustrações esquemáticas de experimentos. (B) Imagens microscópicas confocais de seções cerebrais coronais da amígdala de camundongos do tipo selvagem, mostrando a fluorescência EGFP (B, magenta), imunorreactividades para NeuN (esquerda) e a etiqueta HA (verde) fundidos ao N-terminal de CaMKIIα endógeno. (C) Imagens microscópicas confocais de seções cerebrais coronais do corpo estriado de camundongos do tipo selvagem, mostrando sinal DAPI (esquerda), a fluorescência mCherry (magenta), a fluorescência de mEGFP (verde) fundida ao N-terminal de CaMKIIα endógeno. Crédito:Max Planck Florida Institute for Neuroscience
p (A) Ilustrações esquemáticas de experimentos. (B) Imagens microscópicas confocais de seções cerebrais coronais da amígdala de camundongos do tipo selvagem, mostrando a fluorescência EGFP (B, magenta), imunorreactividades para NeuN (esquerda) e a etiqueta HA (verde) fundidos ao N-terminal de CaMKIIα endógeno. (C) Imagens microscópicas confocais de seções cerebrais coronais do corpo estriado de camundongos do tipo selvagem, mostrando sinal DAPI (esquerda), a fluorescência mCherry (magenta), a fluorescência de mEGFP (verde) fundida ao N-terminal de CaMKIIα endógeno. Crédito:Max Planck Florida Institute for Neuroscience
p O vírus adeno-associado (AAV) é um vírus pouco imunogênico, vírus não tóxico utilizado por cientistas como um mecanismo de entrega eficiente para todos os tipos de genes. Este vírus pode efetivamente fornecer o modelo de doador necessário para HDR, aumentando sua eficiência. A equipe primeiro empacotou o maquinário necessário para a edição do genoma no AAV e o entregou aos neurônios de camundongos transgênicos que expressam Cas9, alcançar HDR espetacularmente eficiente em neurônios pós-mitóticos do cérebro.
p Em seguida, eles criaram um sistema viral duplo que lhes permite usar a tecnologia em animais que não foram projetados para expressar Cas9. Eles testaram este sistema viral duplo em um modelo de camundongo com doença de Alzheimer envelhecido, mostrando que a técnica vSLENDR pode ser aplicável em modelos patológicos, mesmo em idades avançadas.
vSLENDR (marcação de célula única mediada por vírus de proteínas endógenas por reparo dirigido por homologia mediado por CRISPR-Cas9) é uma nova ferramenta poderosa para as ciências básicas e translacionais, capaz de editar com precisão as informações genéticas, independentemente do tipo de célula, maturidade celular, região do cérebro, ou idade. Crédito:Max Planck Florida Institute for Neuroscience p vSLENDR é uma nova ferramenta poderosa para as ciências básicas e translacionais, capaz de editar com precisão as informações genéticas, independentemente do tipo de célula, maturidade celular, região do cérebro, ou idade. O novo vSLENDR é mais eficiente, flexível, e conciso, permitindo aos pesquisadores o potencial para estudar uma miríade de processos e funcionalidades cerebrais com uma facilidade sem precedentes. Igualmente importante é o seu uso potencial em modelos de doenças neuropatológicas, acelerando a pesquisa e o desenvolvimento de novas terapêuticas; estabelecendo a ciência básica de hoje como a base para as curas de amanhã.
p O estudo é publicado em
Neurônio .

