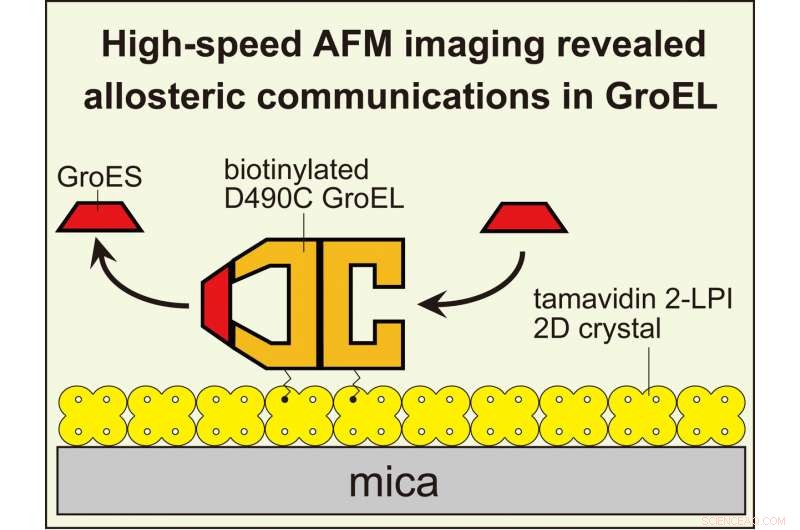
A imagem HS-AFM revelou comunicações alostéricas entre os anéis em GroEL que controlam sua reação de chaperonina. Para visualizar as interações GroEL-GroES dinâmicas com AFM de alta velocidade, GroEL biotinilado em seus domínios equatoriais foi amarrado ao cristal bidimensional de tamavidina 2-LPI formado diretamente na superfície da mica. Crédito:Kanazawa University
As proteínas devem se dobrar de uma maneira específica para funcionar. Isso geralmente é auxiliado por chaperones moleculares - pequenas proteínas cujo trabalho é ajudar outras pessoas a se dobrarem para a forma certa. Agora, Pesquisadores japoneses descobriram que para pelo menos um acompanhante molecular, há mais no processo do que se suspeitava.
Em um jornal em Transações filosóficas da Royal Society , o grupo liderado por Kanazawa focou em GroEL, que é vital para o dobramento de proteínas nas bactérias. O esboço é entendido:GroEL captura uma proteína alvo desdobrada (o substrato) dentro de uma cavidade, onde pode dobrar corretamente sem agregar. Contudo, os detalhes mecanicistas são difíceis de desvendar com os métodos tradicionais de conjunto. No novo estudo, microscopia de força atômica de alta velocidade (HS-AFM) foi usada para visualizar eventos mais diretamente.
GroEL é uma molécula em forma de cilindro, feito de dois anéis empilhados costas com costas. Um parceiro-chave em sua função é a GroES, uma "co-chaperonina" em forma de anel que se liga a cada extremidade de GroEL como uma tampa em forma de cúpula. Somente quando GroEL é limitado por GroES ele pode capturar a proteína do substrato. Então, quando a dobra estiver completa, GroES se dissocia do GroEL, e o substrato dobrado é liberado.
O que fica nebuloso é como os dois anéis em cada extremidade do GroEL cooperam. Os anéis são idênticos, e ambos podem ser limitados por GroES. Quando apenas uma extremidade é limitada, o complexo resultante é denominado "marcador", em virtude de sua aparência pontiaguda. Enquanto isso, a forma com ambas as extremidades é apelidada de "futebol", já que sua forma oval simétrica se assemelha a uma bola de ferro.

Eventos de associação e dissociação de GroES capturados por imagens HS-AFM. Embora a reação proceda principalmente de uma forma alternativa como B? ? F? B? ? F (B e F representam complexos de bala e futebol, respectivamente, e as setas verticais indicam a polaridade dos complexos de marcadores), ocasionalmente ocorre de maneiras diferentes. Crédito:Kanazawa University
"Em um modelo convencional, o ciclo de nivelamento, dobramento de proteínas, e o desbloqueio alterna entre cada anel, "diz o co-autor do estudo, Daisuke Noshiro." O encapsulamento em um anel de GroEL (que tem estereoquímica cis) impede o encapsulamento simultâneo na outra extremidade (trans). Essa comunicação intramolecular é conhecida como alosteria. "Nesta visão, o marcador de capa única é a forma ativa de GroEL, e o futebol é apenas um intermediário de curta duração entre os ciclos.
Outras descobertas, no entanto, sugeriram uma maior complexidade - o que foi destacado por este novo estudo. Dependendo do tipo de substrato, GroEL apareceu como uma bola de futebol, ao invés de uma bala, até 67% do tempo, implicando uma quebra da regulação alostérica negativa. Isso era mais comum quando o substrato era uma proteína não dobrável ou não havia substrato algum, mas mesmo com substratos dobráveis, complexos de futebol abundavam.
Mais inesperadamente, o ciclo ocorreu por duas vias diferentes. No Tipo I predominante, quando o anel ativo de GroEL completa sua tarefa e a outra extremidade assume o bastão, os dois anéis também trocam conformações cis e trans. Contudo, cerca de 25% do tempo (no Tipo II), as conformações não são trocadas, perturbando a circular, ritmo alternado do Tipo I. No entanto, o enovelamento de proteínas ainda ocorre. As bolas de futebol prevalecem em ambos os casos.
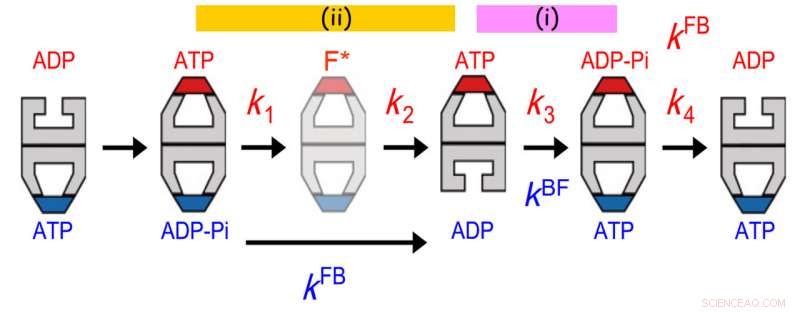
Comunicações alostéricas entre dois anéis de GroEL. A distribuição da vida de GroES ligada foi melhor ajustada a um modelo de reação sequencial de quatro etapas com quatro constantes de taxa, k1, k2, k3 e k4. O valor de k3 coincidiu com o da taxa de transição bala-bola (kBF) no anel oposto. Além disso, o valor de 1 / k1 + 1 / k2 concordou com o de 1 / kFB (kFB, a taxa de transição de futebol para bala no anel oposto). O acordo anterior indica que a hidrólise de ATP em ADP-Pi em um anel atua como um guardião do tempo para a liberação de ADP do anel trans oposto, garantindo a liberação da proteína substrato do anel trans antes de ser tampado com GroES. A última concordância indica que um evento que ocorre na segunda etapa após a ligação de ATP desencadeia a liberação de Pi do anel oposto. Crédito:Kanazawa University
"A estrutura do futebol é tão abundante, deve desempenhar um papel mais ativo do que pensamos, "diz o autor correspondente, Toshio Ando." Este mecanismo complexo é importante, porque as chaperoninas são uma classe natural de máquinas moleculares. As sutilezas do GroEL podem nos ajudar a entender o papel da alosteria em máquinas moleculares de maneira mais geral. "