Usando nanotubos híbridos para melhorar o tratamento do câncer com entrega intracelular de proteínas
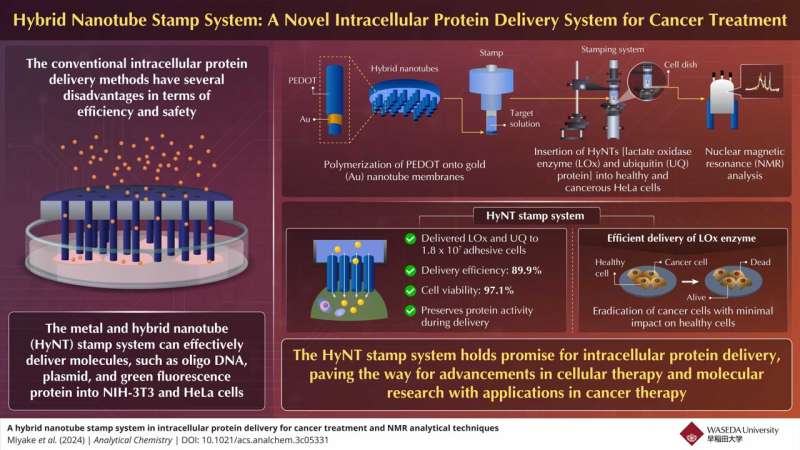 O sistema de carimbo HyNT demonstra a entrega eficiente de moléculas nas células, oferecendo perspectivas promissoras para a terapia do câncer, garantindo ao mesmo tempo alta viabilidade celular. Crédito:Química Analítica (2024). DOI:10.1021/acs.analchem.3c05331
O sistema de carimbo HyNT demonstra a entrega eficiente de moléculas nas células, oferecendo perspectivas promissoras para a terapia do câncer, garantindo ao mesmo tempo alta viabilidade celular. Crédito:Química Analítica (2024). DOI:10.1021/acs.analchem.3c05331 A entrega intracelular de proteínas é uma técnica importante para desvendar as funções celulares, a estrutura do complexo proteico e a terapêutica. No entanto, os métodos de entrega convencionais têm várias limitações.
Para resolver isso, pesquisadores do Japão desenvolveram um novo sistema de carimbo de nanotubos híbridos (HyNT) que pode fornecer múltiplas proteínas com altas taxas de eficiência e viabilidade. Este sistema representa um avanço na entrega intracelular de proteínas, oferecendo injeção precisa de agentes terapêuticos nas células-alvo.
No cenário médico atual, a medicina de precisão e as terapias direcionadas estão ganhando força por sua capacidade de adaptar tratamentos a pacientes individuais, minimizando ao mesmo tempo os efeitos adversos.
Os métodos convencionais, como as técnicas de transferência de genes, mostram-se promissores na entrega de genes terapêuticos diretamente às células para tratar várias doenças. No entanto, estes métodos enfrentam desvantagens significativas, dificultando a sua eficácia e segurança.
A entrega intracelular de proteínas oferece uma abordagem promissora para o desenvolvimento de terapias mais seguras, direcionadas e eficazes. Ao transferir diretamente proteínas para células-alvo, este método contorna questões como o silenciamento durante a transcrição e tradução e o risco de mutações indesejáveis a partir da inserção do DNA. Além disso, a entrega intracelular de proteínas permite a distribuição precisa de proteínas terapêuticas nas células-alvo sem causar toxicidade.
Um grupo de pesquisadores liderado pelo professor Takeo Miyake da Universidade Waseda, no Japão, em colaboração com o Grupo Mikawa do Instituto RIKEN, desenvolveu agora um sistema híbrido de carimbo de nanotubos para entrega intracelular de proteínas. Esta técnica inovadora permite a entrega simultânea de diversas cargas, incluindo corante de calceína, enzima lactato oxidase (LOx) e proteína ubiquitina (UQ), diretamente em células adesivas para tratamento de câncer.
Um artigo descrevendo a pesquisa foi publicado em Analytical Chemistry . Este artigo foi coautor do Dr. Tsutomu Mikawa, Dr. Bingfu Liu, Sr. Zhouji Wu e Sr. Kazuhiro Oyama da Universidade de Waseda, Japão.
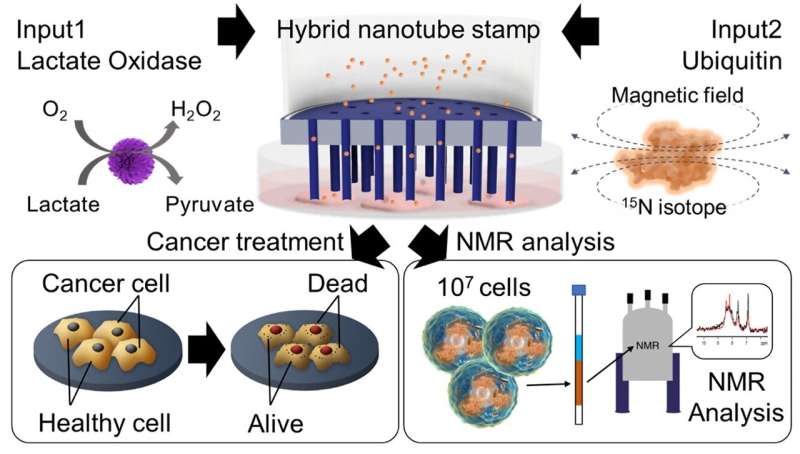 O sistema de carimbo HyNT fornece efetivamente LOx e UQ de 1,8 × 10
7
células adesivas com viabilidade de 97,1%. Este sistema, através da entrega da enzima LOx, pode erradicar eficazmente as células cancerígenas com impacto mínimo nas células saudáveis. Crédito:Química Analítica (2024). DOI:10.1021/acs.analchem.3c05331
O sistema de carimbo HyNT fornece efetivamente LOx e UQ de 1,8 × 10
7
células adesivas com viabilidade de 97,1%. Este sistema, através da entrega da enzima LOx, pode erradicar eficazmente as células cancerígenas com impacto mínimo nas células saudáveis. Crédito:Química Analítica (2024). DOI:10.1021/acs.analchem.3c05331
Miyake explica brevemente a montagem do sistema de carimbo. "Os HyNTs foram sintetizados através da polimerização PEDOT em membranas de nanotubos de Au e depois montados com um tubo de vidro para criar um selo capaz de inserir fisicamente HyNTs nas células."
Os pesquisadores exploraram o potencial terapêutico da entrega da enzima LOx para o tratamento do câncer. "Através do nosso sistema de carimbo inovador, entregamos LOx com sucesso tanto em células-tronco mesenquimais saudáveis (MSC) quanto em células HeLa cancerosas. Embora as células MSC permanecessem inalteradas, observamos morte celular significativa em células cancerígenas HeLa após o tratamento com LOx, com viabilidades diminuindo ao longo do tempo.
“Nossas descobertas destacam a eficácia promissora da LOx administrada intracelularmente no direcionamento e na morte seletiva das células cancerígenas, ao mesmo tempo em que poupa as células saudáveis, oferecendo uma estratégia terapêutica direcionada para o tratamento do câncer”, explica Miyake.
Por fim, a equipe entregou com sucesso
15
Proteínas UQ marcadas com isótopos N em células HeLa usando o sistema de carimbo HyNT. Esta entrega permitiu a análise de estruturas proteicas complexas e interações dentro das células.
Além disso, imagens ópticas e de fluorescência confirmaram a presença de UQ entregue em células HeLa, e a espectroscopia de ressonância magnética nuclear combinou a concentração intracelular da proteína UQ com a de uma solução contendo
15
UQ marcado com N.
Estes resultados demonstram a eficácia do sistema de carimbo na entrega de proteínas alvo para análise posterior.
Os resultados demonstram a notável capacidade do sistema de carimbo HyNT em fornecer LOx e UQ em um número substancial de células adesivas, conforme necessário para aplicações em medicina regenerativa.
O sistema alcançou uma eficiência de entrega notavelmente elevada de 89,9%, indicando a sua eficácia no transporte de proteínas terapêuticas para as células alvo com precisão. Além disso, a taxa de viabilidade celular de 97,1% destaca a capacidade do sistema de manter a saúde e a integridade das células tratadas durante todo o processo de entrega.
O sistema de carimbo HyNT oferece potencial transformador na entrega intracelular de proteínas, com aplicações que vão desde o tratamento do câncer até a análise molecular. Para além da medicina, a sua versatilidade estende-se à agricultura e às indústrias alimentares, prometendo avanços na produção agrícola e no desenvolvimento de produtos alimentares.
Com manipulação celular precisa e entrega eficiente, o sistema de carimbo HyNT está preparado para revolucionar a pesquisa biomédica, a prática clínica e diversas indústrias, abrindo caminho para intervenções personalizadas e moldando o futuro da medicina moderna.

