Proteínas de impressão digital com força abre um novo caminho para proteômica de molécula única
Crédito:Universidade de Harvard
À medida que os cientistas investigam os mistérios da vida em escalas cada vez menores, eles inventam ferramentas para ajudá-los a entender o que observam. Determinar a identidade de moléculas de DNA e RNA agora se tornou comum graças ao desenvolvimento comercial de tecnologias de sequenciamento de última geração, mas o mesmo ainda não é verdade para proteínas, que são atores criticamente importantes em quase todos os processos biológicos. As proteínas são muito mais complexas do que o DNA e o RNA, e muitas vezes são modificadas quimicamente, tornando o objetivo de identificar facilmente proteínas únicas dentro de uma amostra (proteômica de molécula única) difícil de alcançar.
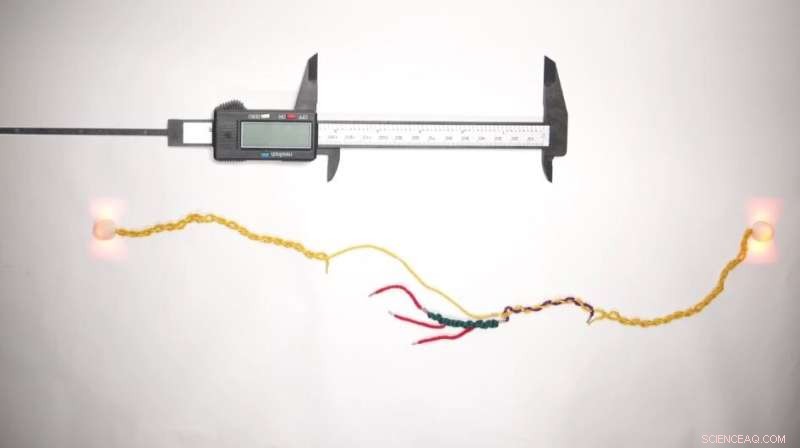
Agora, cientistas que trabalham na Molecular Robotics Initiative no Wyss Institute da Universidade de Harvard, no Blavatnik Institute na Harvard Medical School (HMS) e no Boston Children's Hospital (BCH) usaram DNA, o material fundamental da própria vida, para criar o que pode ser a menor régua do mundo para medir proteínas.
Apelidada de "DNA Nanoswitch Calipers" (DNC), essa tecnologia permite que os pesquisadores realizem medições de distância em peptídeos únicos (os blocos de construção das proteínas) com alta precisão, aplicando pequenas quantidades de força. Ao fazer rapidamente muitas medições de distância na mesma molécula, o DNC cria uma "impressão digital" única que pode ser usada para identificá-la em experimentos subsequentes. A conquista é relatada em
Nature Nanotechnology .
"Quando você está tentando entender algo em biologia, existem dois métodos principais de investigação:você pode observar seu assunto em seu estado natural, ou você pode perturbá-lo e ver como ele reage. mas às vezes a melhor maneira de aprender sobre algo é interagir fisicamente com ele", disse o co-autor correspondente Wesley Wong, Ph.D., membro do corpo docente associado do Wyss Institute e professor associado do HMS, que também é pesquisador do BCH . “Determinar o padrão de aminoácidos dentro de uma molécula peptídica aplicando força é um novo paradigma na busca científica em andamento por técnicas que nos permitirão sequenciar proteínas tão facilmente quanto atualmente sequenciamos o DNA”.
Use a força O DNC é baseado na tecnologia subjacente do nanointerruptor de DNA:uma única fita de DNA com "alças" moleculares anexadas a ela em vários pontos ao longo de seu comprimento. Quando duas dessas alças se ligam, elas criam uma alça na fita de DNA e o comprimento total da fita é encurtado. Quando a força é aplicada para separar as alças, o fio se estende de volta ao seu comprimento original. A diferença entre o comprimento do fio em seus estados em loop e sem loop reflete o tamanho do loop e, portanto, a distância entre as alças.
A equipe de pesquisa percebeu que eles poderiam levar os nanointerruptores de DNA um passo adiante:se eles, em vez disso, projetassem as alças para se ligarem a uma biomolécula, as alças poderiam efetivamente "beliscar" a molécula entre si como as duas pontas de um paquímetro, em vez de se ligarem umas às outras. outro. Ao medir como a adição da molécula alvo entre as alças alterou o comprimento total do nanointerruptor de DNA em seus estados em loop versus não em loop, a equipe levantou a hipótese de que poderia medir efetivamente o tamanho da molécula.
“De certa forma, os nanointerruptores de DNA aproveitam um dos métodos mecânicos mais clássicos para medir objetos:basta aplicar força a algo e ver como isso muda em resposta”, disse o co-primeiro autor Darren Yang, pesquisador de pós-doutorado no Wyss Institute e BCH. "É uma abordagem que realmente não vimos usada no campo da proteômica de molécula única, porque aplicar força a objetos tão pequenos é incrivelmente desafiador. Mas estávamos à altura do desafio."
Para transformar sua ideia de uma nova técnica de medição baseada em força em realidade, Yang e seus colegas primeiro anexaram dois tipos diferentes de alças a uma molécula alvo:uma alça "forte" para ancorar firmemente a molécula em uma extremidade do DNC e várias alças "fracas" que podem ser anexadas à outra extremidade do DNC. Eles então amarraram ambas as extremidades do DNC a duas esferas "opticamente presas" suspensas em feixes de laser. Ao aproximar as contas, eles induziram uma das alças fracas da molécula alvo a se ligar ao DNC, criando um estado de loop. Quando eles então aumentaram a força, afastando as contas, a alça fraca finalmente liberou sua ligação, retornando o DNC ao seu estado mais longo e sem loop.
A equipe testou pela primeira vez essa técnica em moléculas simples de DNA de fita simples (ssDNA) e confirmou que a mudança nas medições de distância entre o estado em loop e não em loop do DNC se correlacionava diretamente com o comprimento da molécula alvo. Essas mudanças de comprimento podem ser medidas com precisão em nível de angstrom (que é dez vezes menor que a largura de uma dupla hélice de DNA), permitindo a identificação de mudanças de comprimento tão pequenas quanto a de um único nucleotídeo.
Como a molécula alvo contém várias alças fracas que podem se ligar ao DNC, ciclos repetidos de ligação e quebra dessas alças criam uma série de medições de distância entre a alça forte e as alças fracas que são exclusivas para cada molécula medida. Essa "impressão digital" pode ser usada para identificar uma molécula conhecida dentro de uma amostra ou para inferir informações estruturais sobre uma molécula desconhecida.
Provas de proteínas Tendo confirmado que o DNC poderia medir de forma confiável o tamanho das moléculas de DNA, os pesquisadores mudaram o foco para seu objetivo real:proteínas. Eles projetaram um peptídeo sintético (uma cadeia curta de aminoácidos) com um comprimento e sequência conhecidos e repetiram o experimento, anexando-o a uma extremidade do DNC
via a alça forte e repetidamente prendendo e quebrando as ligações entre suas alças fracas e o DNC, aplicando diferentes quantidades de força. Eles descobriram que todas as distâncias que sua ferramenta mediu entre as alças fortes e fracas correspondiam às distâncias esperadas com base no comprimento do DNC e nos comprimentos dos aminoácidos no peptídeo. Eles também obtiveram resultados semelhantes quando usaram o DNC para medir um peptídeo linearizado de ocorrência natural chamado NOXA BH3.
Esse processo também gerou impressões digitais de medição exclusivas para cada peptídeo. A equipe criou um modelo de computador para prever quantas proteínas humanas poderiam ser identificadas exclusivamente usando esse método e descobriu que mais de 75% das proteínas em um banco de dados de proteínas comumente usado poderiam ser identificadas
via impressões digitais com uma probabilidade de pelo menos 90%.
"Na verdade, ficamos um pouco surpresos com o quão bem essa técnica funcionou", disse o co-primeiro autor Prakash Shrestha, Ph.D., pós-doutorando no Wyss Institute e no BCH. "As pinças ópticas existem há décadas e o ciclo de DNA entre um estado em loop e sem loop existe há cerca de 10 anos, e não tínhamos certeza se poderíamos obter medições de alta resolução combinando essas ideias. Mas acabou que essas impressões digitais são muito eficazes para identificar proteínas."
Identificar moléculas de proteína única é um feito impressionante, mas ser capaz de fazer isso para várias proteínas simultaneamente é o verdadeiro santo graal para a proteômica de molécula única. A equipe demonstrou ainda que, substituindo as contas ópticas por um sistema de pinça magnética, eles foram capazes de realizar medições em vários peptídeos diferentes em paralelo, bem como determinar as concentrações relativas de diferentes moléculas.
"A proteômica de uma única molécula ainda é em grande parte um sonho devido aos desafios de dimensionamento e resolução. Nosso presente trabalho mostra que a impressão digital de sequência baseada em força tem o potencial de realizar esse sonho", disse o co-autor correspondente William Shih, Ph.D. , membro do corpo docente do Wyss Institute e professor do HMS e do Dana-Farber Cancer Institute. "Nossa ambição final é ler eficientemente não apenas sequências de proteínas, mas também estruturas de proteínas de maneira de alto rendimento".
O próximo passo dos cientistas em direção a esse objetivo é validar seus compassos para medições estruturais de baixa força em proteínas dobradas e seus complexos, investigando seu uso potencial para biologia estrutural e proteômica. Eles também estão trabalhando para aumentar o rendimento da tecnologia para acelerar ainda mais a análise de amostras mistas.
"Esta pesquisa integra biofísica molecular com nanotecnologia de DNA de ponta, pioneira aqui no Wyss Institute para nos permitir interagir e analisar moléculas biológicas de uma maneira verdadeiramente nova. Molecular Robotics Initiative, realmente parecia ficção científica, mas esse é exatamente o tipo de projeto que queremos assumir no Wyss. Estou muito orgulhoso da equipe por tornar essa tecnologia uma realidade - ela tem o potencial de mudar totalmente como fazemos ciência e desenvolvemos terapias", disse o diretor fundador da Wyss, Don Ingber, MD, Ph.D., que também é professor de biologia vascular Judah Folkman na Harvard Medical School e BCH, e professor de bioengenharia na Harvard John A. Escola Paulson de Engenharia e Ciências Aplicadas.
+ Explorar mais Democratizando a análise de força de molécula única de alto rendimento
