A pesquisa identifica o mecanismo químico que mostra como o ferro nos solos pode imobilizar o arsênico
 p A pesquisadora do Sandia National Laboratories, Anastasia Ilgen, faz experimentos em uma caixa de luvas anaeróbica. Crédito:Randy Montoya
p A pesquisadora do Sandia National Laboratories, Anastasia Ilgen, faz experimentos em uma caixa de luvas anaeróbica. Crédito:Randy Montoya
p Pesquisadores do Sandia National Laboratories descobriram o mecanismo para "ligar" o ferro residente em estruturas minerais de argila, levando à compreensão de como tornar o ferro reativo em condições livres de oxigênio. p Esta pesquisa ajudará os cientistas a compreender e prever como os contaminantes, como o arsênico, selênio e cromo, mover-se pelo meio ambiente e entrar nos cursos d'água. Esses princípios químicos podem ser aplicados para desenvolver barreiras naturais do solo para remover esses contaminantes da água e fazer membranas reativas, que pode transformar contaminantes durante o processo de filtração de água.
p O trabalho é capa de uma edição recente da
Ciência Ambiental:Nano em um artigo intitulado, "'Ligando' o ferro em minerais de argila, "pelos pesquisadores da Sandia Anastasia Ilgen, Kevin Leung e Rachel Washington e Ravi Kukkadapu do Pacific Northwest National Laboratory. O trabalho foi financiado pelo programa de Ciências Energéticas Básicas do Departamento de Energia.
p
Compreendendo as reações de ferro
p “Em geociências, reconhecemos há décadas que entender como o ferro reage é fundamental para entender como os contaminantes se movem e se transformam no meio ambiente, "disse o autor principal Ilgen.
p O ferro é um constituinte chave da crosta terrestre e o quarto elemento mais comum. Minerais que contêm ferro constituem uma grande parte dos solos e rochas sedimentares. Adsorção e transformações químicas em superfícies minerais contendo ferro definem o destino e transporte de produtos químicos no meio ambiente. Adsorção, que é a fixação de contaminantes em superfícies minerais, e as reações químicas nessas superfícies minerais governam como esses produtos químicos se movem no meio ambiente.
p Ilgen explica que o ferro nos solos pode existir em dois estados de oxidação:reduzido e oxidado. Isso é importante, porque o ferro alterna constantemente entre essas formas em resposta a pequenas mudanças nas condições do solo.
p "Minerais de argila são extremamente comuns em solos e muitas vezes contêm ferro em suas estruturas, "disse ela." As superfícies dos minerais de argila, que contém apenas ferro oxidado, não são reativos. Eles adsorvem arsênico, mas não o transforme quimicamente. Contudo, essas mesmas superfícies tornam-se reativas assim que uma pequena quantidade de ferro reduzido é introduzida na estrutura do argilomineral. "
p Até agora, não se sabia como e por que os minerais de argila com vestígios de ferro reduzido reagem quando não há oxigênio.
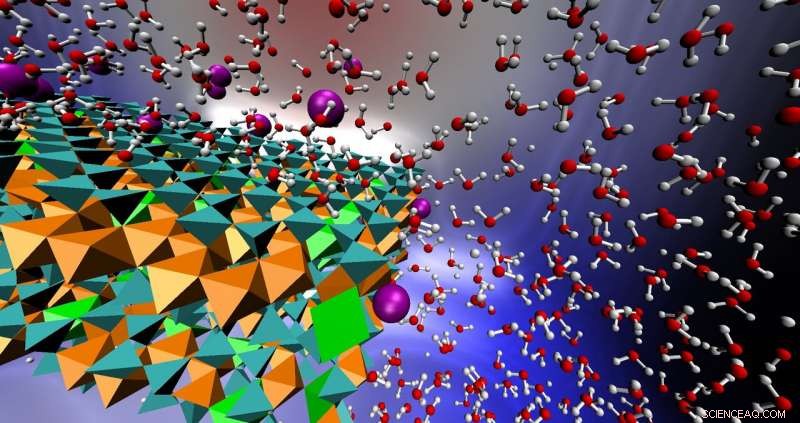 p Este gráfico mostra o sistema reativo descrito no artigo, exibindo a estrutura do mineral de argila nontronita com ferro oxidado (laranja) e ferro reduzido (verde brilhante) rodeado por água e íons de arsênio (roxo). Crédito:Tuan Ho
p Este gráfico mostra o sistema reativo descrito no artigo, exibindo a estrutura do mineral de argila nontronita com ferro oxidado (laranja) e ferro reduzido (verde brilhante) rodeado por água e íons de arsênio (roxo). Crédito:Tuan Ho
p "Nós descobrimos o mecanismo pelo qual o ferro oxidado em estruturas minerais de argila reage sob condições livres de oxigênio, e por que traços de ferro reduzido são necessários para que as reações ocorram, "Ilgen disse.
p
A equipe realiza o trabalho usando várias ferramentas, métodos
p Usando ferramentas experimentais, a equipe localizou os locais químicos exatos em minerais de argila que reagiram com o arsênico. A equipe mostrou que os átomos de ferro localizados nas bordas dos minerais de argila eram reativos, e para que as reações ocorram, esses locais devem conter ferro reduzido e oxidado.
p A equipe usou métodos computacionais para calcular a energia necessária para oxidar o arsênio, que é adsorvido em um local contendo exclusivamente ferro oxidado versus um local com ferro oxidado e reduzido. Esses cálculos mostraram que a adição termodinâmica de um ferro reduzido ao lado de um ferro oxidado não torna a oxidação do arsênico mais favorável.
p Então, a questão é:por que os sites são reativos no ambiente? Usando análise espectroscópica, a equipe demonstrou que, para um contaminante, como o arsênico, para oxidar na superfície de um mineral de argila, deve deslocar as moléculas de água da superfície desse mineral de argila. Separar uma molécula de água é uma etapa química necessária para ligar o arsênico, para poder oxidá-lo na superfície do mineral argiloso.
p Os cálculos mostram que a remoção de água de um local com ferro reduzido e oxidado usa menos energia em comparação com um local que contém apenas ferro oxidado. Porque usa menos energia, é mais fácil primeiro anexar e depois oxidar o arsênio neste tipo de local químico na superfície do mineral de argila e é por isso que a reação ocorre.
p Compreender esse mecanismo ajuda a explicar o destino e o transporte de nutrientes sensíveis a redox e contaminantes no meio ambiente, e por que alguns deles persistem em formas oxidadas, mesmo na ausência de oxigênio dissolvido.
p Continuando a pesquisa sobre o ferro em diferentes minerais naturais
p Ilgen disse que a equipe continuará pesquisando os mecanismos químicos que regem a reatividade do ferro em diferentes minerais naturais e explorará as condições necessárias para que o ferro seja reativo em solos e rochas sedimentares.
p A equipe usará esse conhecimento para entender melhor o destino ambiental e o transporte de contaminantes e nutrientes, e potencialmente projetar barreiras reativas para evitar que contaminantes entrem nos cursos d'água.

