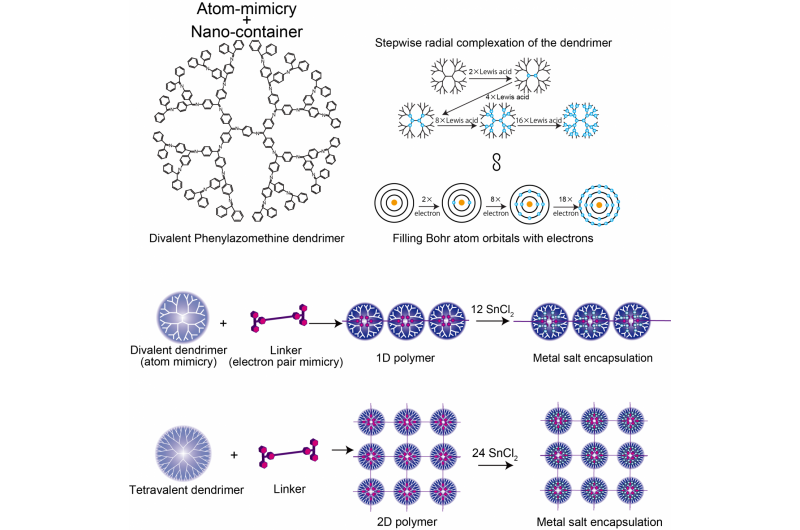
 p A estrutura do dendrímero de fenilazomentina divalente, Comparação do modelo de átomo DPA e Bohr, e polímero supramolecular 1D / 2D. Crédito:Instituto de Tecnologia de Tóquio
p A estrutura do dendrímero de fenilazomentina divalente, Comparação do modelo de átomo DPA e Bohr, e polímero supramolecular 1D / 2D. Crédito:Instituto de Tecnologia de Tóquio
p Na nanotecnologia, o controle é fundamental. O controle sobre os arranjos e distâncias entre as nanopartículas pode permitir intensidades de interação sob medida para que as propriedades possam ser aproveitadas em dispositivos como sensores plasmônicos. Agora, pesquisadores do Instituto de Tecnologia de Tóquio usam dendrímeros que imitam a valência do elétron dos átomos e os ligam em matrizes usando moléculas que se coordenam com o dendrímero, pois formariam um par de elétrons covalente em sua camada de valência - "mimetismo do par de elétrons". p Kimihisa Yamamoto, Ken Albrecht, e colegas da Tokyo Tech consideraram a polifenilazometina dendrítica (DPA), que tem uma estrutura que se ramifica a partir de um núcleo central. As moléculas de "ácido de Lewis" coordenam-se com os locais de "base de Lewis" do DPA. A análise da proporção de moléculas de ácido de Lewis SnCl2 que se coordenam com cada dendrímero revelou aumentos de etapa de 2 para 4 para 8 para 16, que imita a valência do átomo de Bohr que tem 2, 8, 18, e 32 elétrons no primeiro, 2, 3º, e 4os orbitais. Isso reflete o aumento no número de moléculas que podem coordenar com o dendrímero com o aumento da distância do núcleo, à medida que o número de ramificações do dendrímero e a densidade do elétron aumentam.
p A equipe de Yamamoto analisou a coordenação do DPA com um ácido de Lewis de ligação mais forte - trifenilmetílio (TPM) - ligado à molécula semelhante a uma haste fenileno etinileno. A estrutura do filenoetinileno é rígida o suficiente para que os cátions ácidos em ambas as extremidades não possam se ligar ao mesmo dendrímero. Em vez disso, uma cadeia de polímero de dendrímeros se forma. O uso de um dendrímero inicial diferente (ZnPG4 em vez de DPAG4) - que tem uma valência central de quatro em vez de dois - levou à formação de polimerização bidimensional dos dendrímeros, produzindo uma matriz 2D de nanocontêineres para que possam acumular outros ácidos de Lewis nos orbitais externos.
p O trabalho descreve "um novo aspecto do mimetismo do átomo", concluem os pesquisadores. "A geometria e o passo podem ser controlados pelo projeto do dendrímero e do ligante e são potencialmente aplicáveis a plasmônicos (após o crescimento mediado por sementes) e grades de nanoeletrodos (que também são úteis como eletrocatalisadores)."
p O estudo é publicado em
Avanços da Ciência .
p
Átomo de Bohr
p O modelo de Bohr do átomo estabelecido por Niels Bohr e Ernest Rutherford em 1913 descreve o átomo como um núcleo positivo rodeado por elétrons em diferentes camadas ou níveis de energia. Cada camada tem um número prescrito de elétrons que podem ocupá-la - isto é, dois elétrons podem ocupar a primeira camada, oito no proximo, e dezoito no próximo, e assim por diante.
p Embora existam aspectos do comportamento do átomo que o modelo não cobre, é particularmente bem-sucedido em explicar as linhas de emissão espectral. Quando animado, um elétron pode saltar para o próximo nível de energia. Quando ele retorna ao nível de energia inicial, a diferença nas energias é emitida como luz no comprimento de onda específico equivalente à diferença de energia.
p Onde uma concha não está cheia, o átomo pode se ligar a outra espécie química. Desta forma, a valência de um átomo descreve quão cheia está a camada de elétrons e quão prontamente as ligações podem se formar. O gradiente de densidade de elétrons dos dendrímeros movendo-se radialmente do núcleo para as regiões externas mais ramificadas determina quantas moléculas de coordenação de ácido de Lewis ele pode acomodar e, dessa forma, imita os níveis de energia do átomo de Bohr.
p
O que é um ácido de Lewis
p Um ácido de Lewis é uma espécie química que pode aceitar um par solitário de elétrons de uma substância química que pode doar um par solitário, isso é, de uma base de Lewis. Esse comportamento é definido pela estrutura eletrônica do produto químico. Os ácidos de Lewis incluem compostos ácidos, mas também cátions metálicos.
p Quando o dendrímero se coordena com os ácidos de Lewis, ele toma o lugar da base de Lewis que doaria um par de elétrons. Os pesquisadores descrevem o composto ácido di-Lewis (molécula ligante) como mimetismo de pares de elétrons.
p
Pontos isosbestic
p Quando dois produtos químicos reagem, a quantidade de luz absorvida pode mudar dependendo da quantidade de luz que os produtos e os reagentes absorvem. Se os produtos e reagentes absorvem a mesma quantidade de luz em um determinado comprimento de onda, é descrito como o ponto isosbéstico.
p Os pesquisadores usaram pontos isosbestic para identificar os aumentos graduais do ácido de Lewis reagindo com os dendrímeros. Uma mudança no comprimento de onda no ponto isosbéstico indica a coordenação do ácido de Lewis para a camada subsequente do dendrímero.
